※このウェブページは中学校理科3年の学習内容です。<3年p.126>
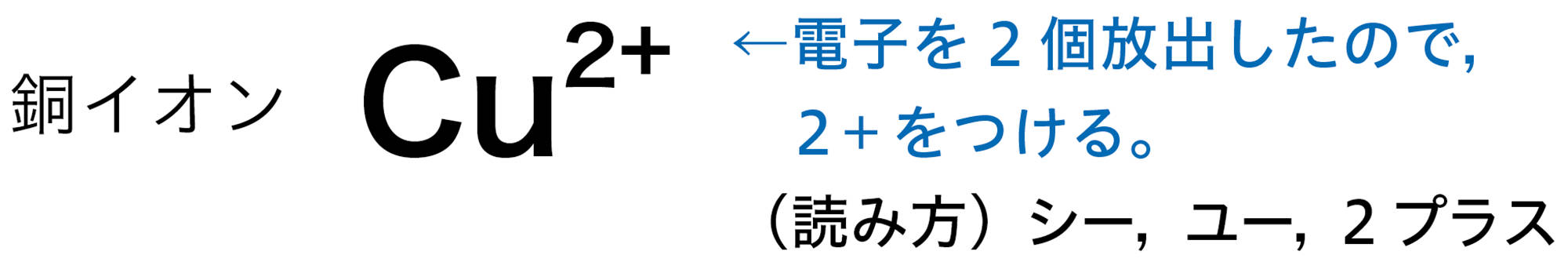
2|イオンの化学式
1 陽イオン・陰イオン
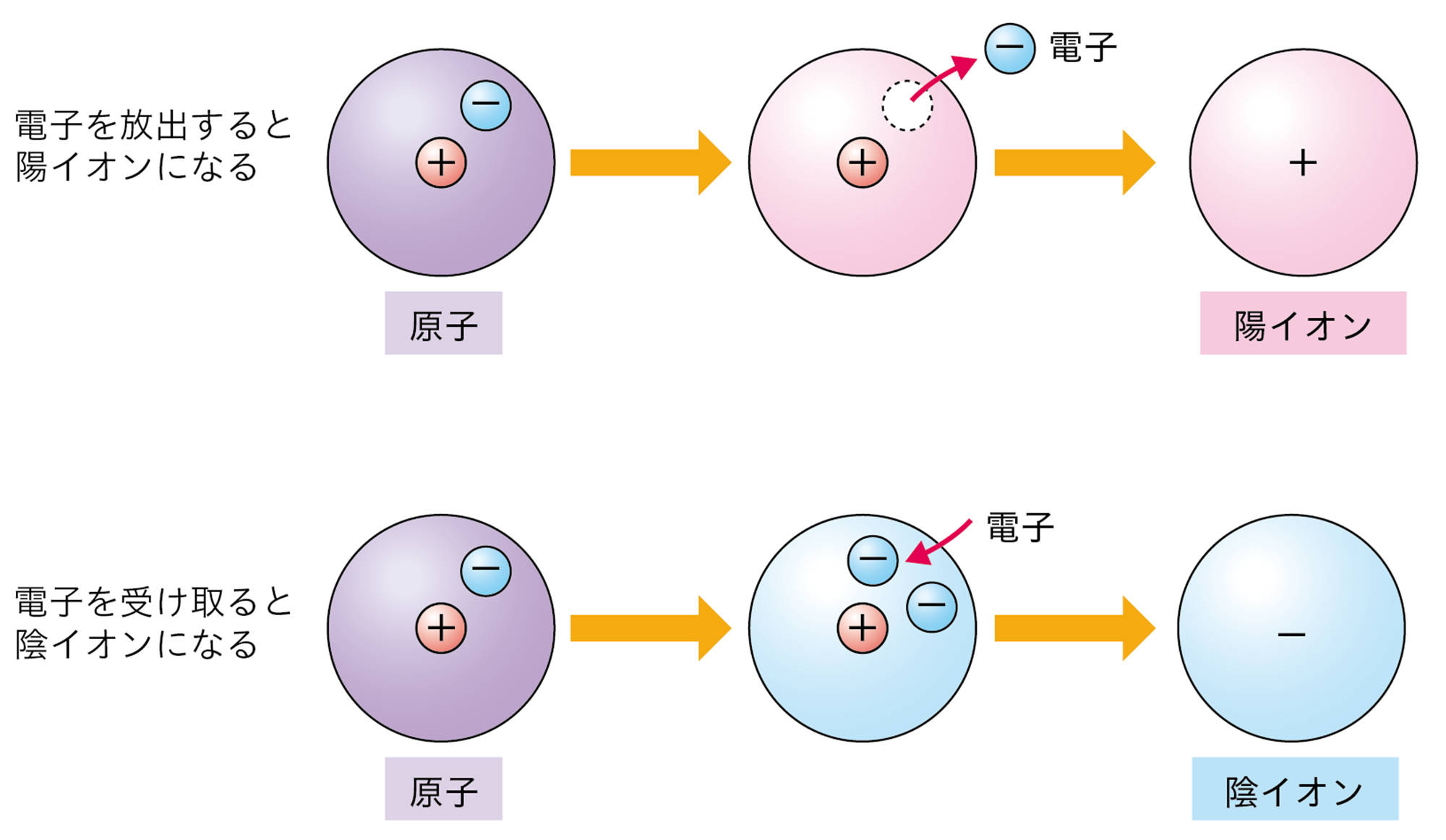
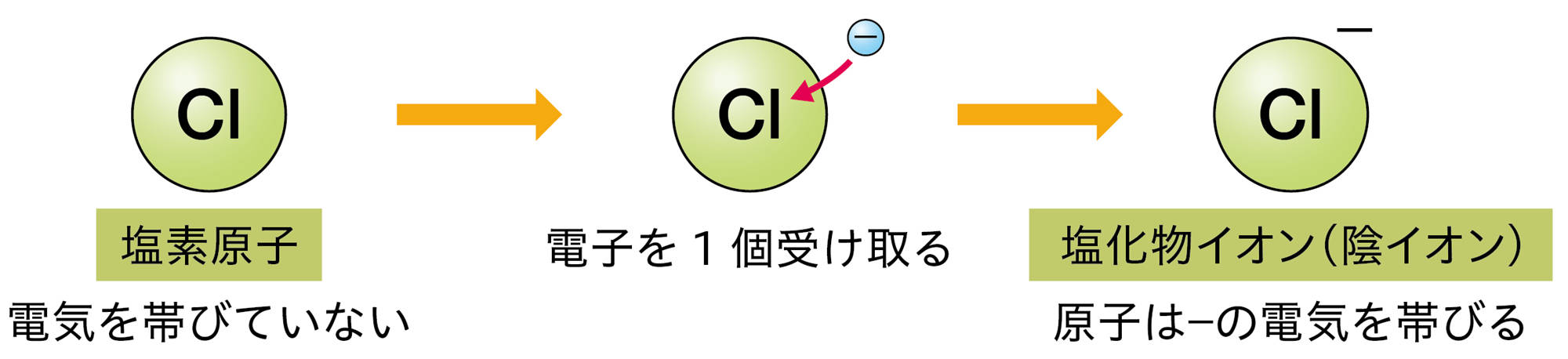
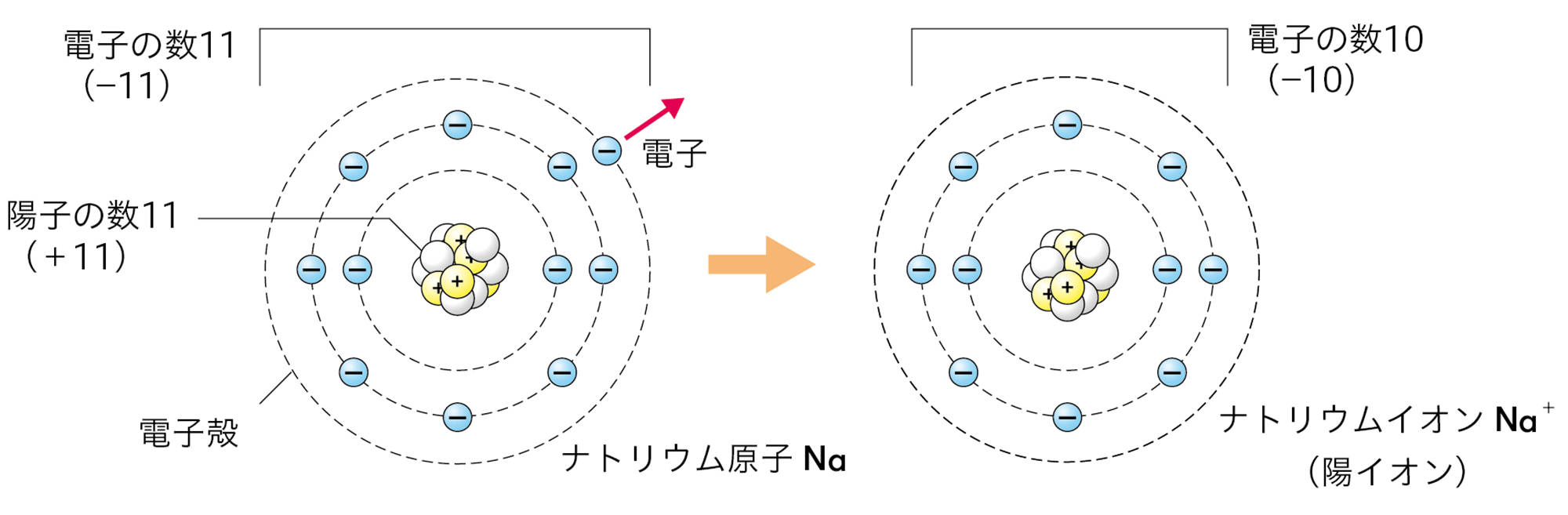
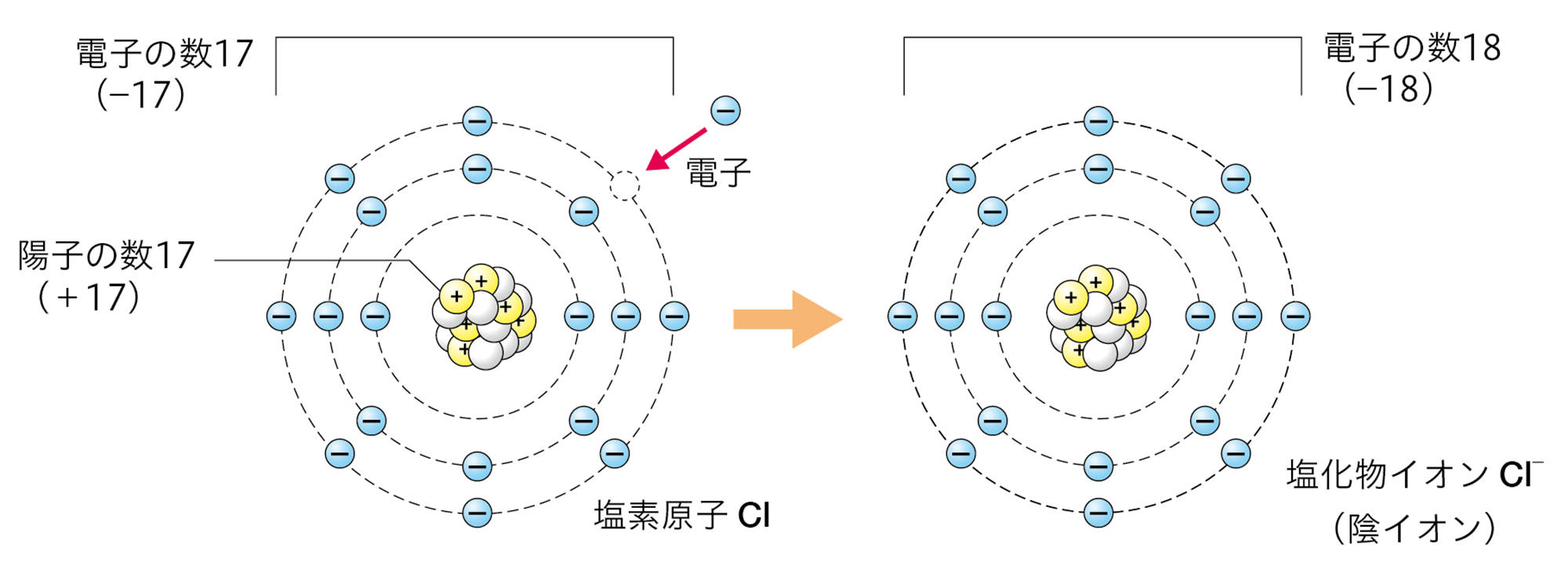
原子は自らの電子を放出したり,ほかの原子から電子を受け取ったりすることがある。原子が電子を放出すると,原子全体は+の電気を帯びて,【陽イオン】になる。原子が電子を受け取ると,原子全体は − の電気を帯びて,【陰イオン】になる❶(図9)。
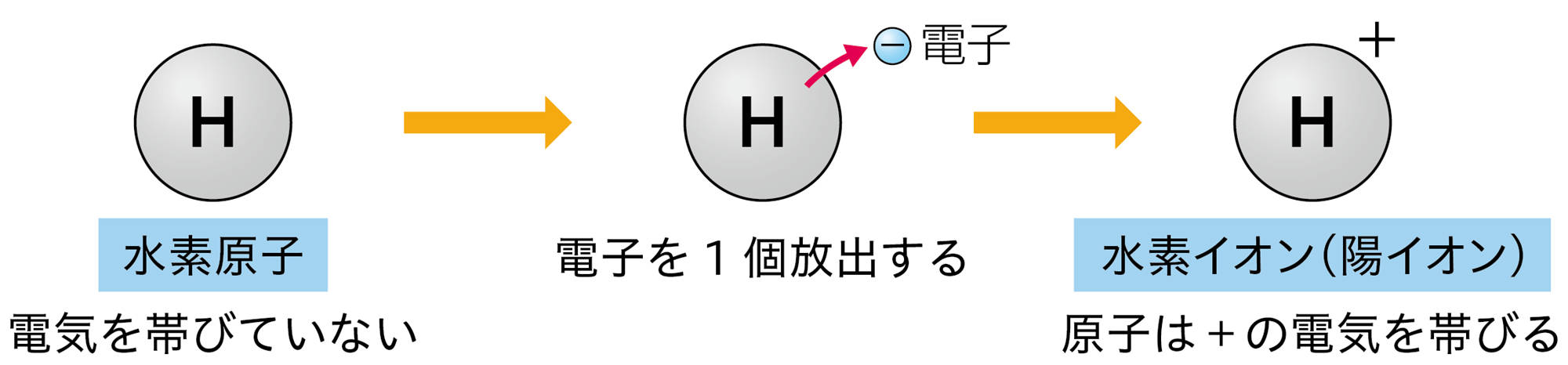
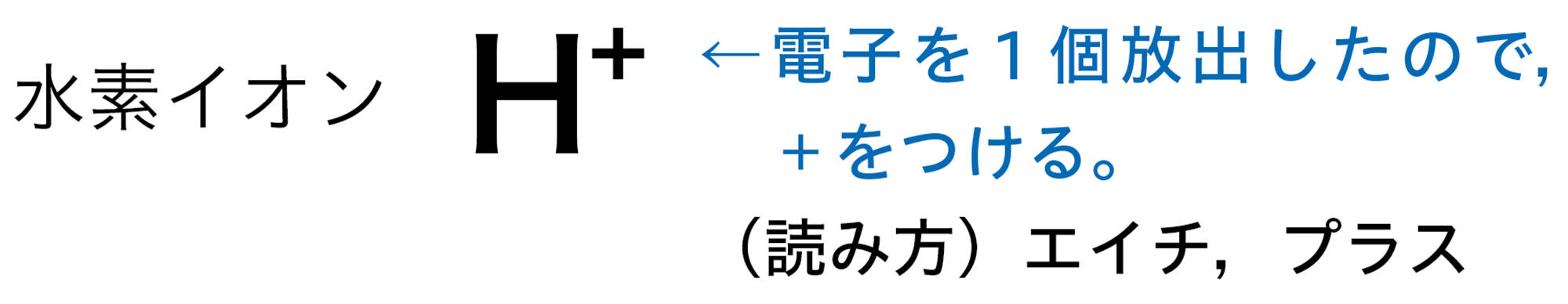
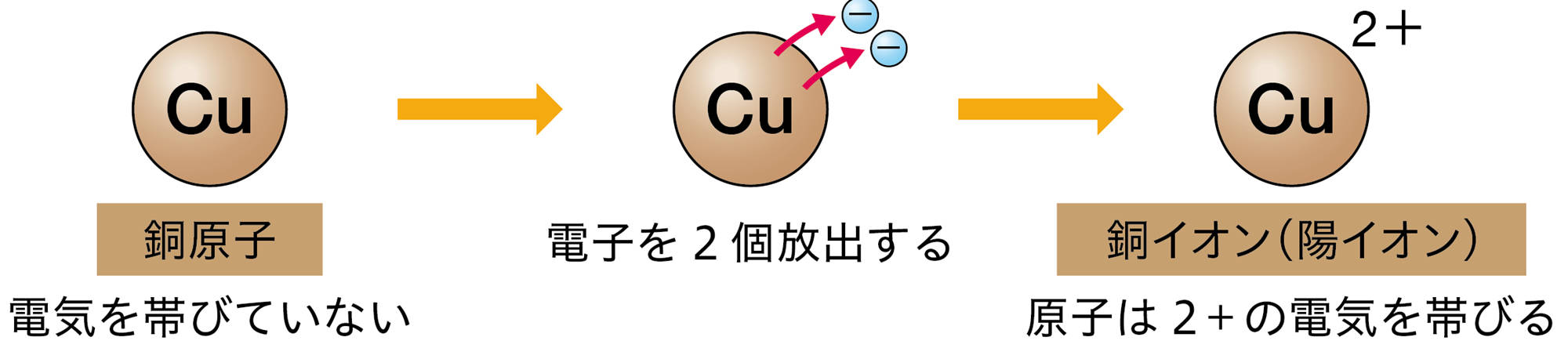
原子が放出したり,受け取ったりする電子の数は,原子の種類によって決まっている❷。たとえば,水素原子は1個の電子を放出して陽イオンに,塩素原子は1個の電子を受け取って陰イオンになる(図10)。
図10 原子がイオンになるときの表し方
❶ 「陽」とは「+」の意味,「陰」とは「−」の意味である。
❷ 原子の種類によって,もともともっている電子の数は決まっている。また,放出しやすい,受け取りやすい電子があり,際限なく電子を放出したり,受け取ったりするわけではない。
※このウェブページは中学校理科3年の学習内容です。<3年p.127>
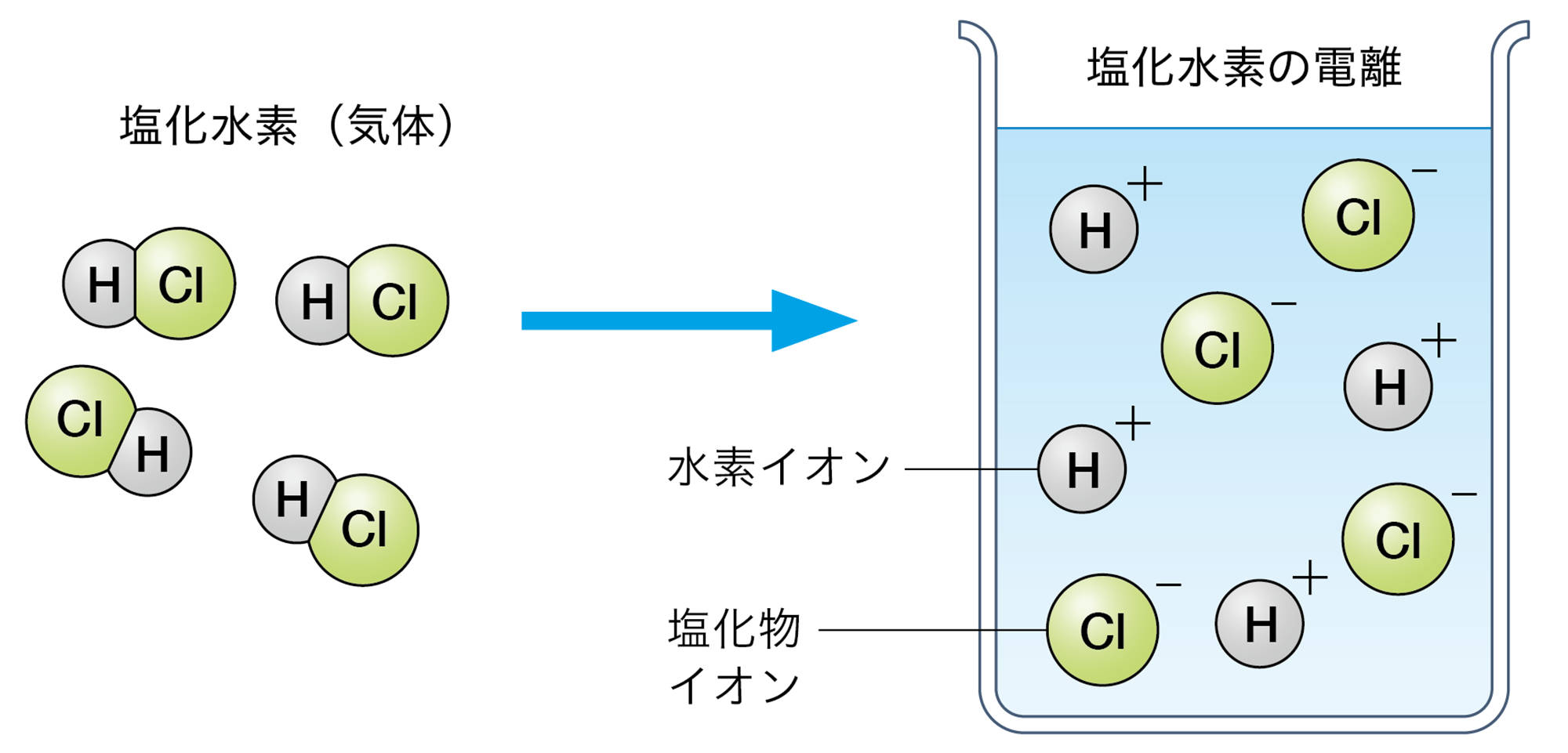
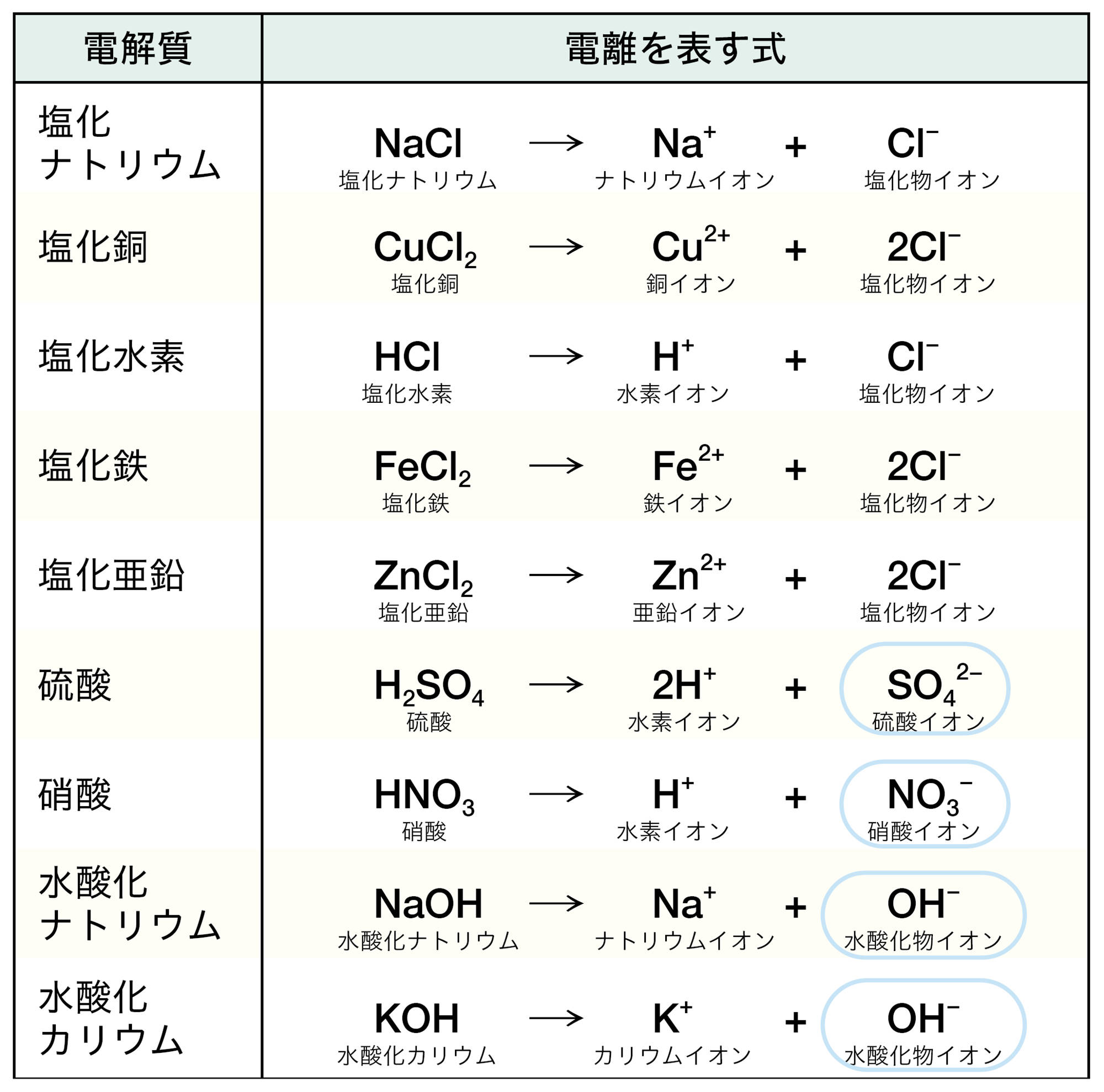
2 電離
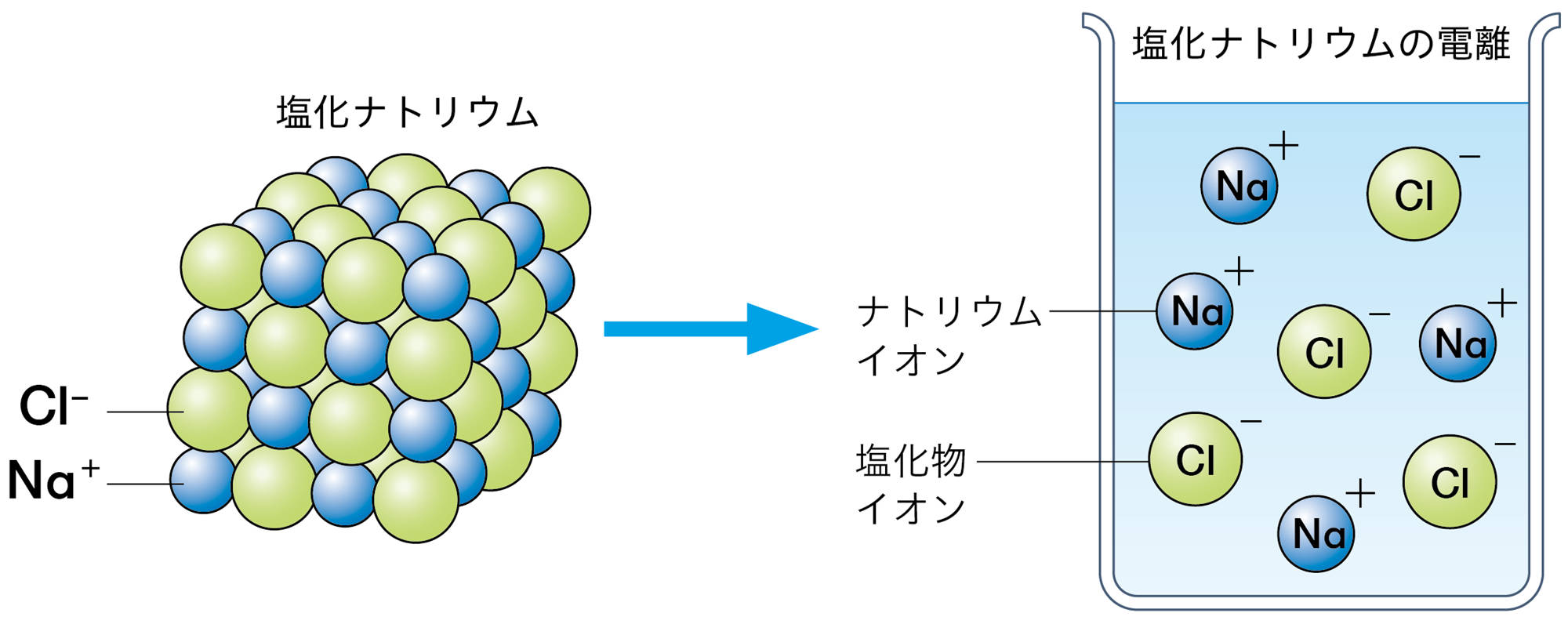
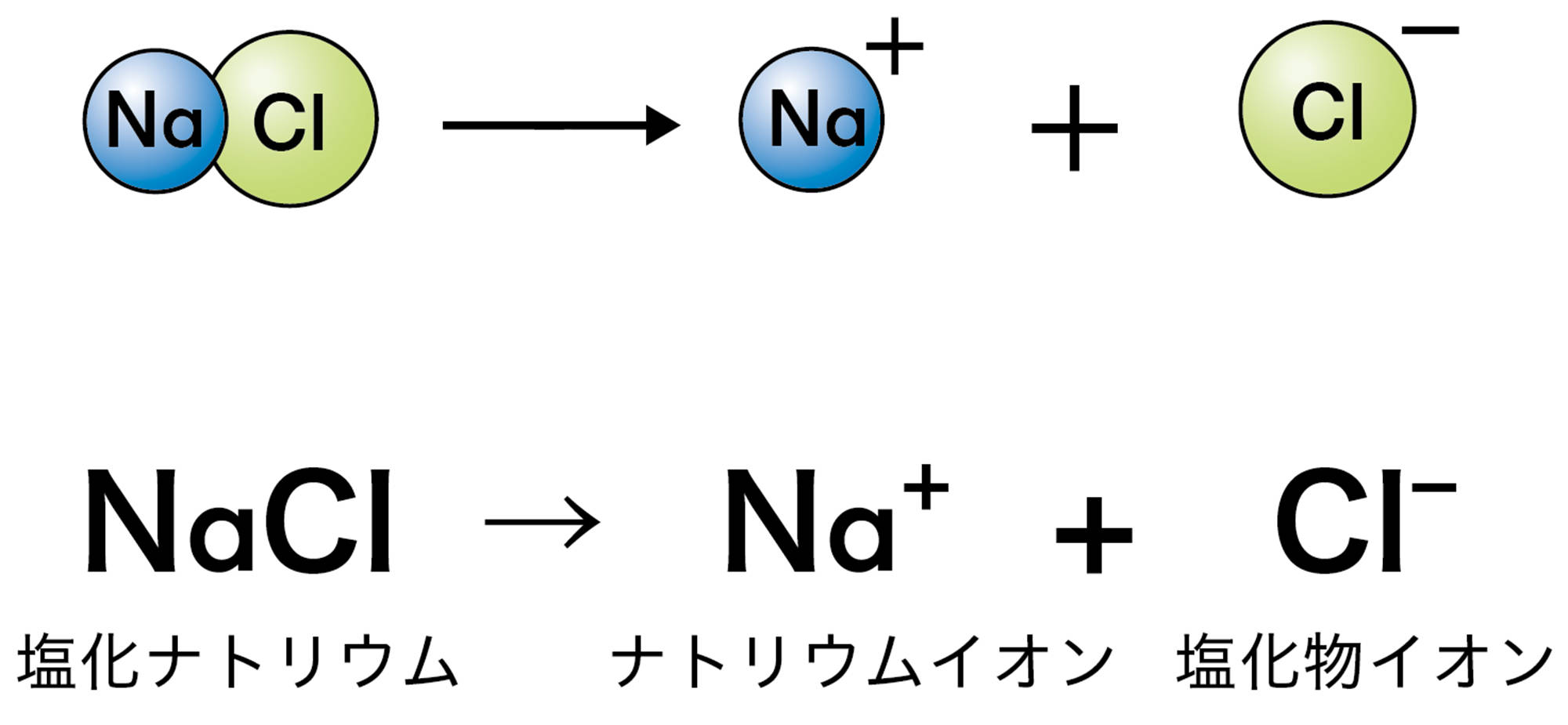
電解質が水溶液中で陽イオンと陰イオンに分かれることを【電離】という(図11)。電解質の電離のようすは,イオンの化学式を使って図12のように表すことができる。
図13 イオンからなる物質の電離
右列のボタンから,イオンカードのアプリを利用することもできます。

※このウェブページは中学校理科3年の学習内容です。<3年p.128>
3 電解質とイオン
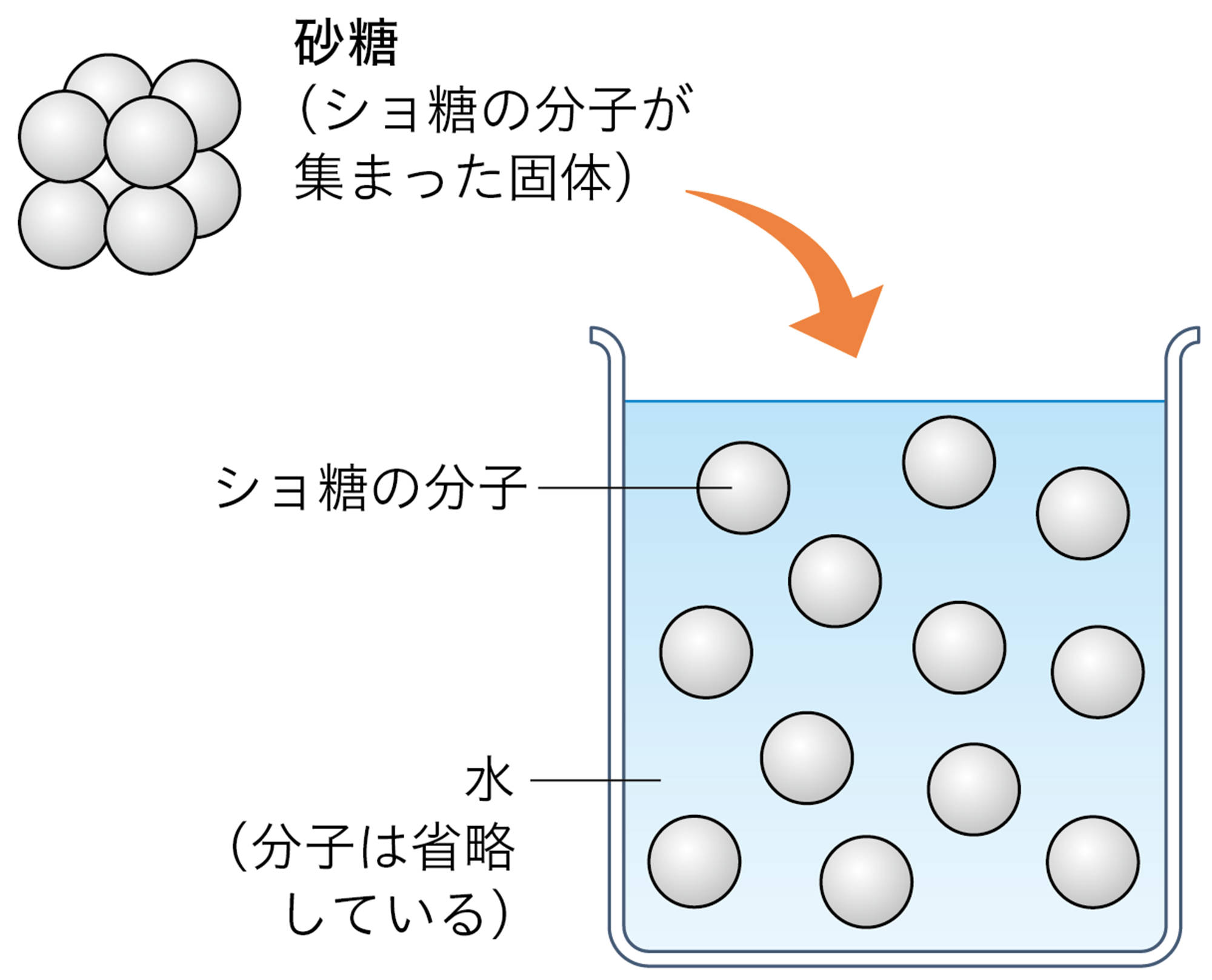
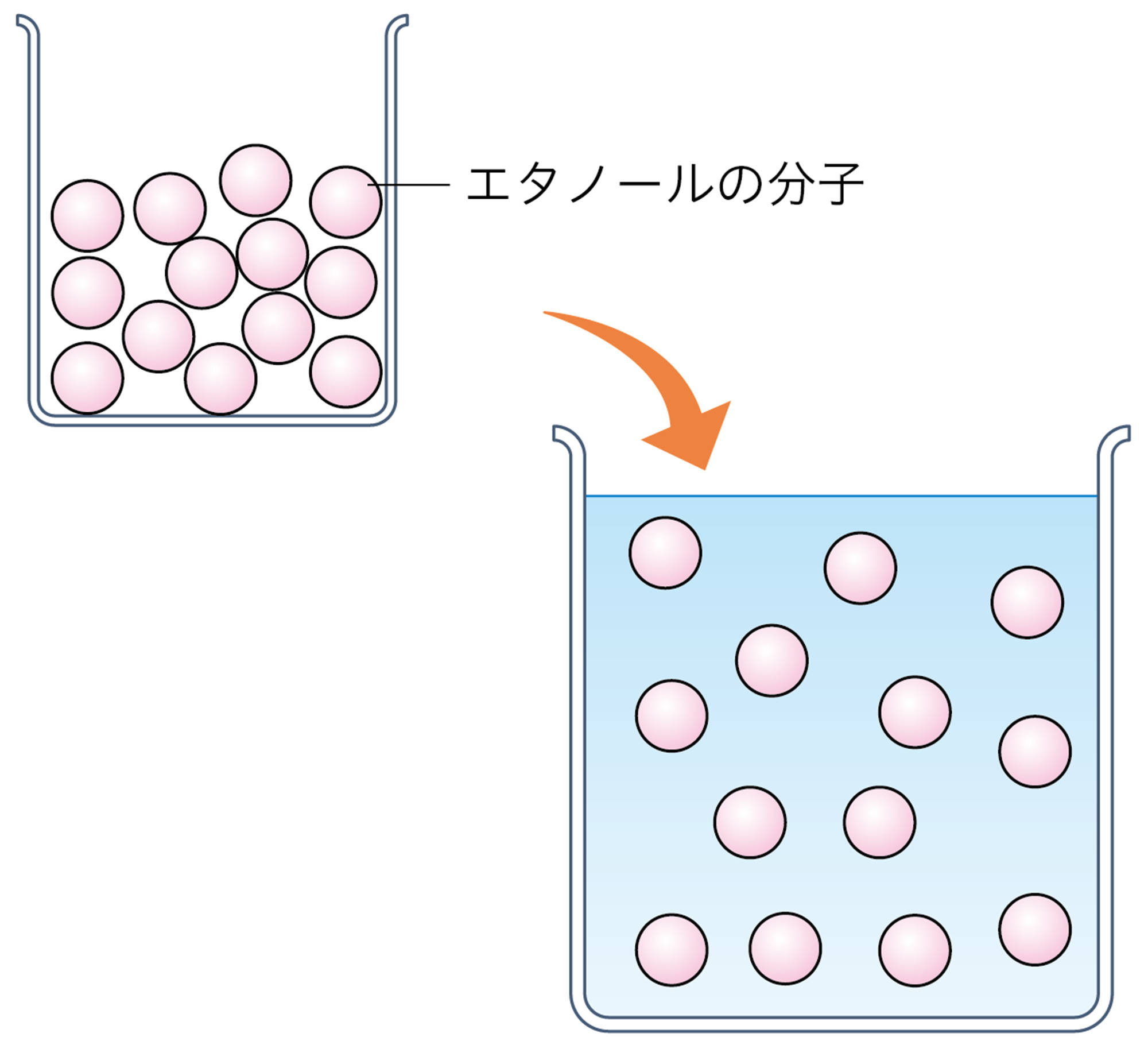
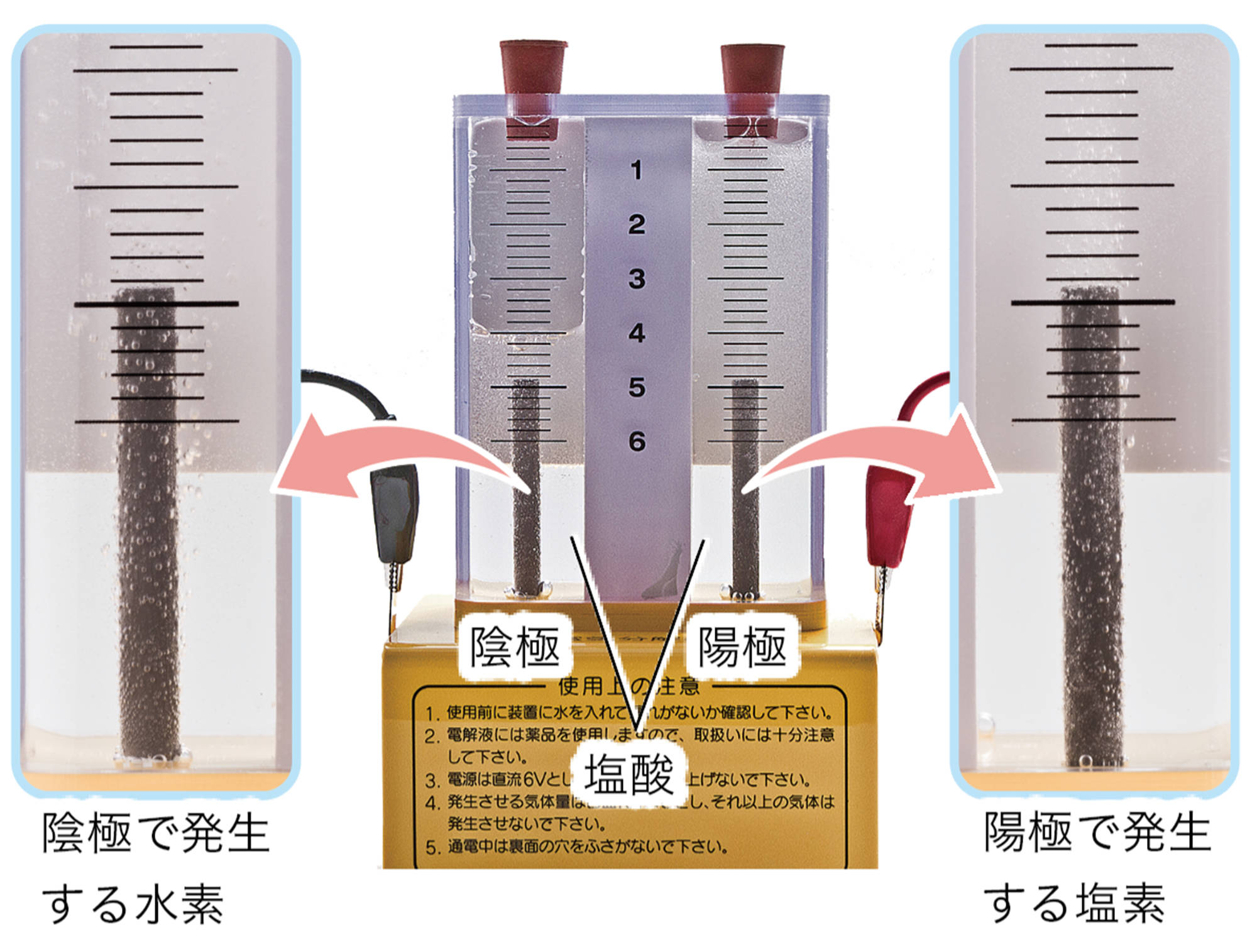
電解質は水に溶けたときにイオンが生じる物質で(表2),生じたイオンは,水溶液に電流を流す原因になる。エタノールや砂糖などの非電解質は,水に溶けてもイオンが生じないため,水溶液は電流を流さない(図14)。

Clが塩素原子を表すのに,Cl⁻は「塩素イオン」ではないんだね。Hが水素原子で,H⁺は「水素イオン」なのに。

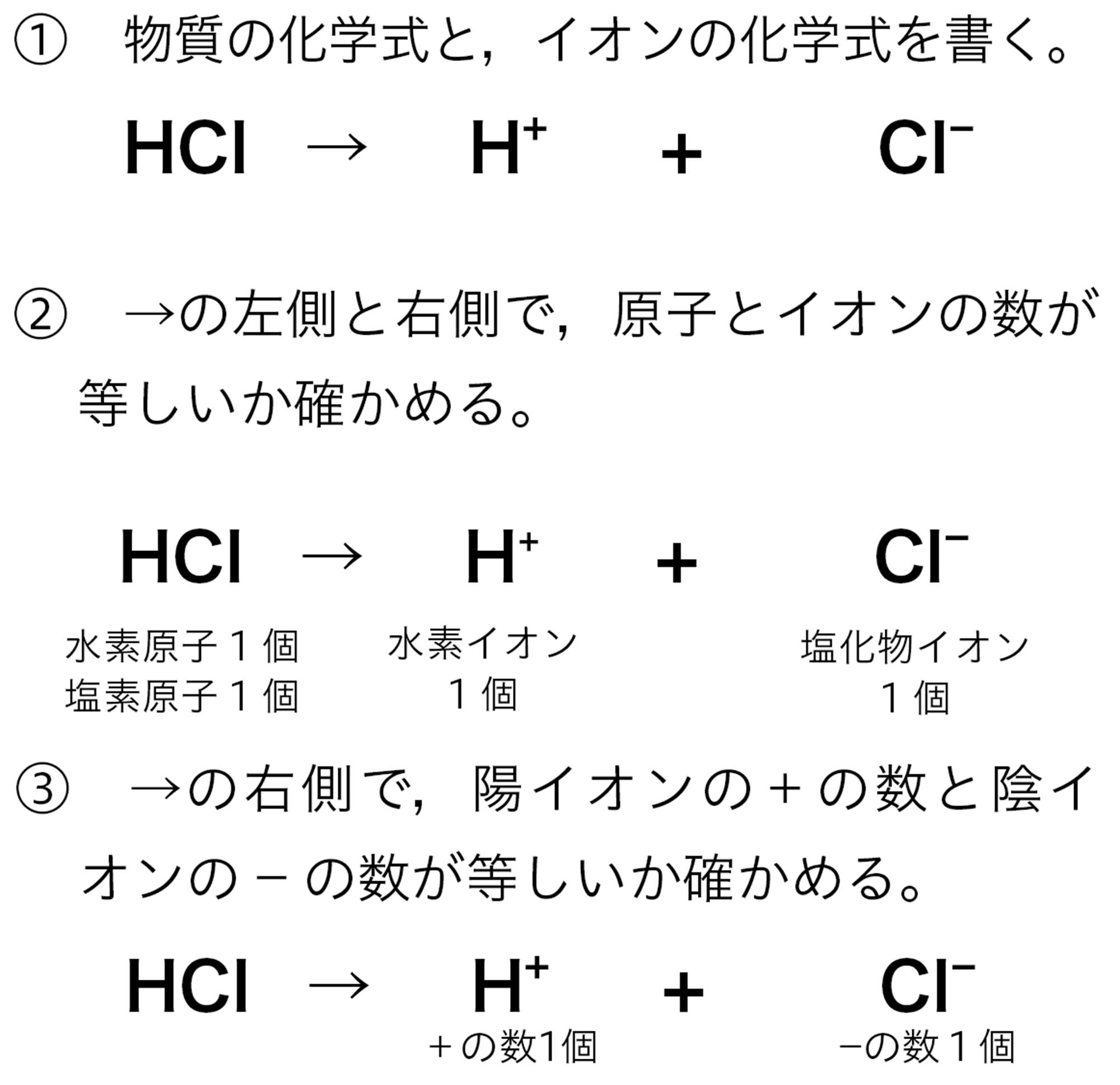
1個の原子がイオンになるときには,その呼び方は次のように表すことになっています。
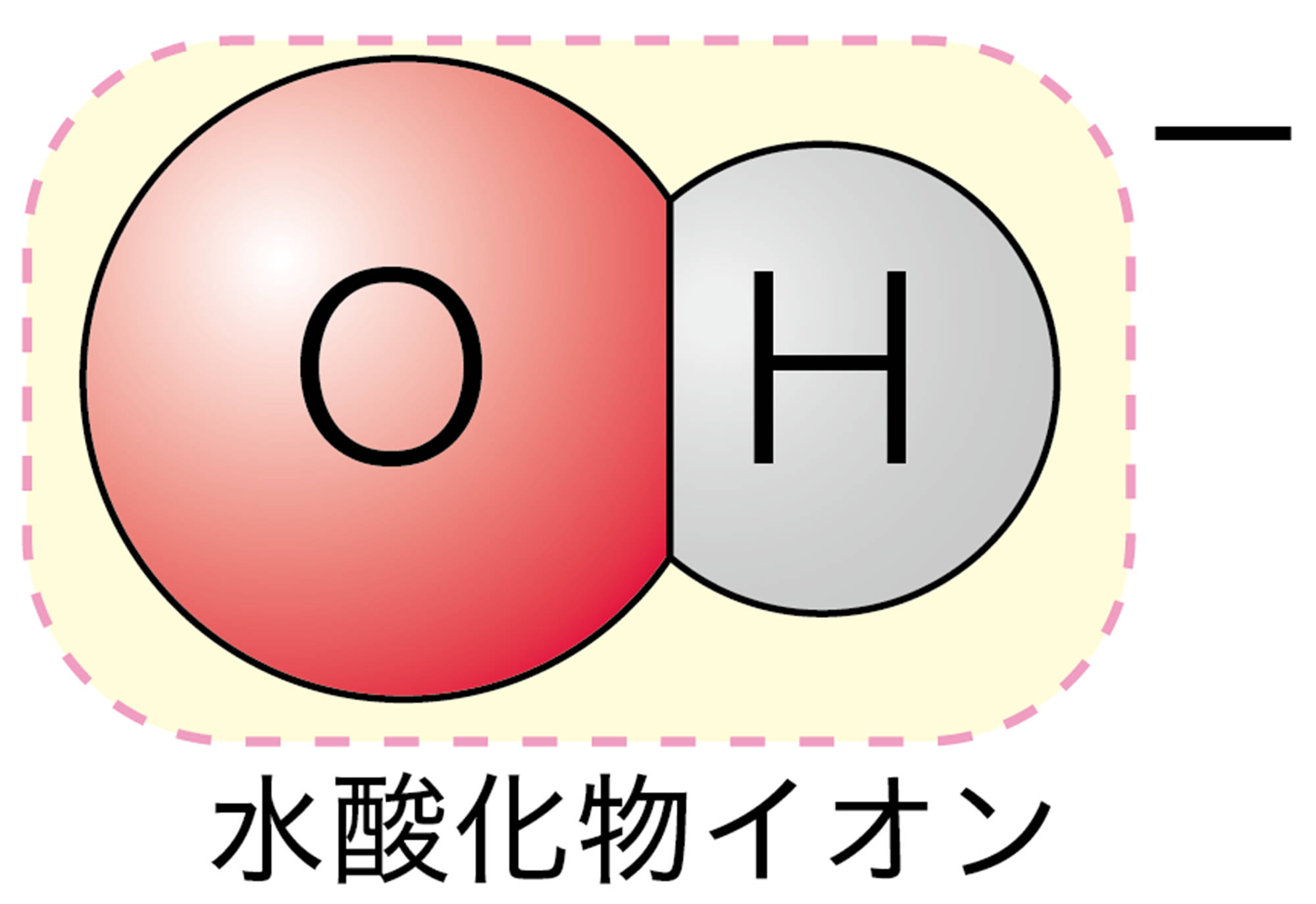
・ 陰イオンは,語尾を変えて「~化物イオン」をつける。
この決まりにしたがうと,陽イオンであるH⁺ は「“水素”イオン」で,陰イオンであるCl⁻は「“塩”化物イオン」になりますよね。陰イオンには,ほかにフッ素原子F が1個の電子を受け取ってできるフッ化物イオンF⁻などがあります。なお,2個以上の原子の集まりからなるイオンには,それぞれ固有の呼び方があります。

※このウェブページは中学校理科3年の学習内容です。<3年p.261>
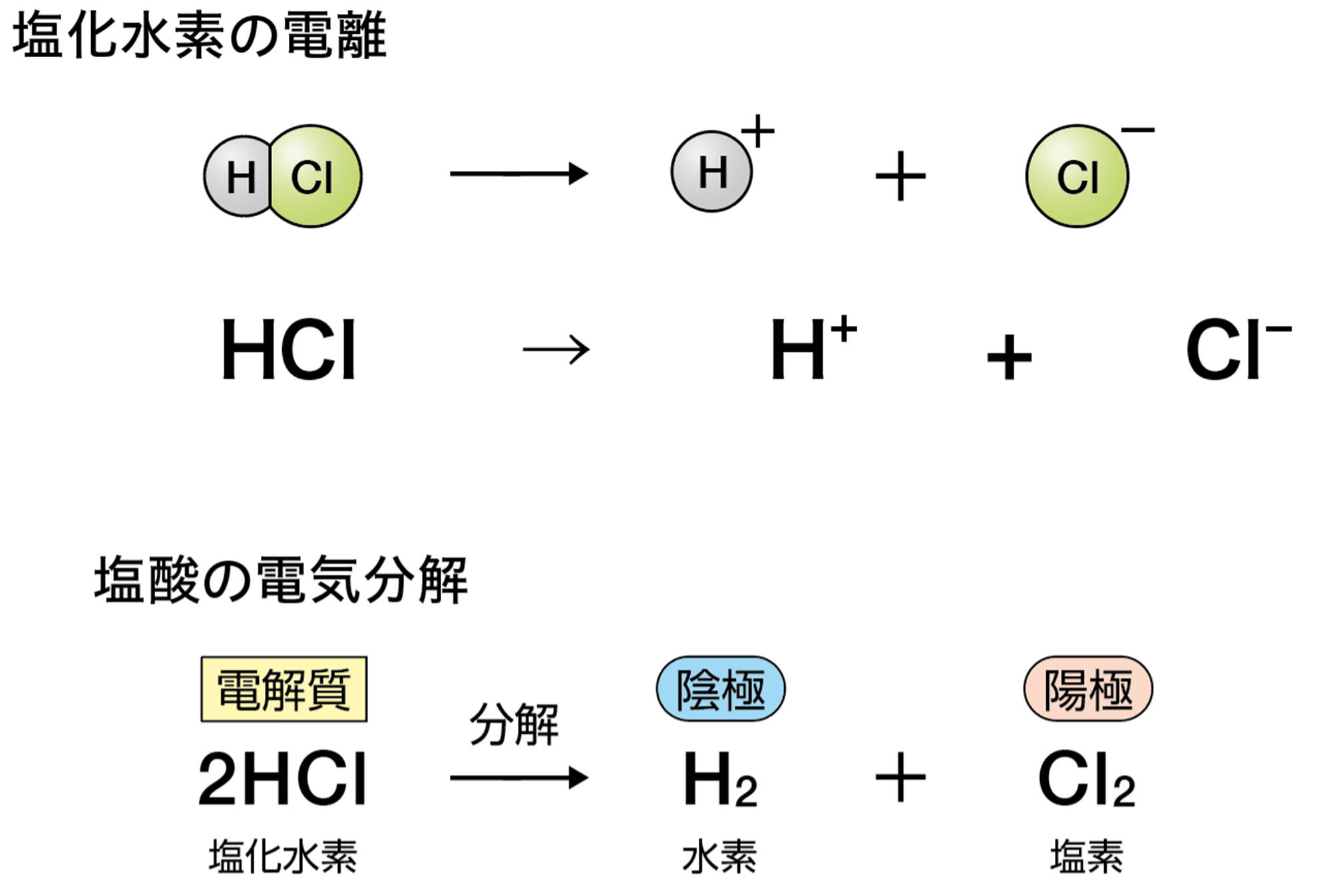
発展 電気分解と電池は何がちがう
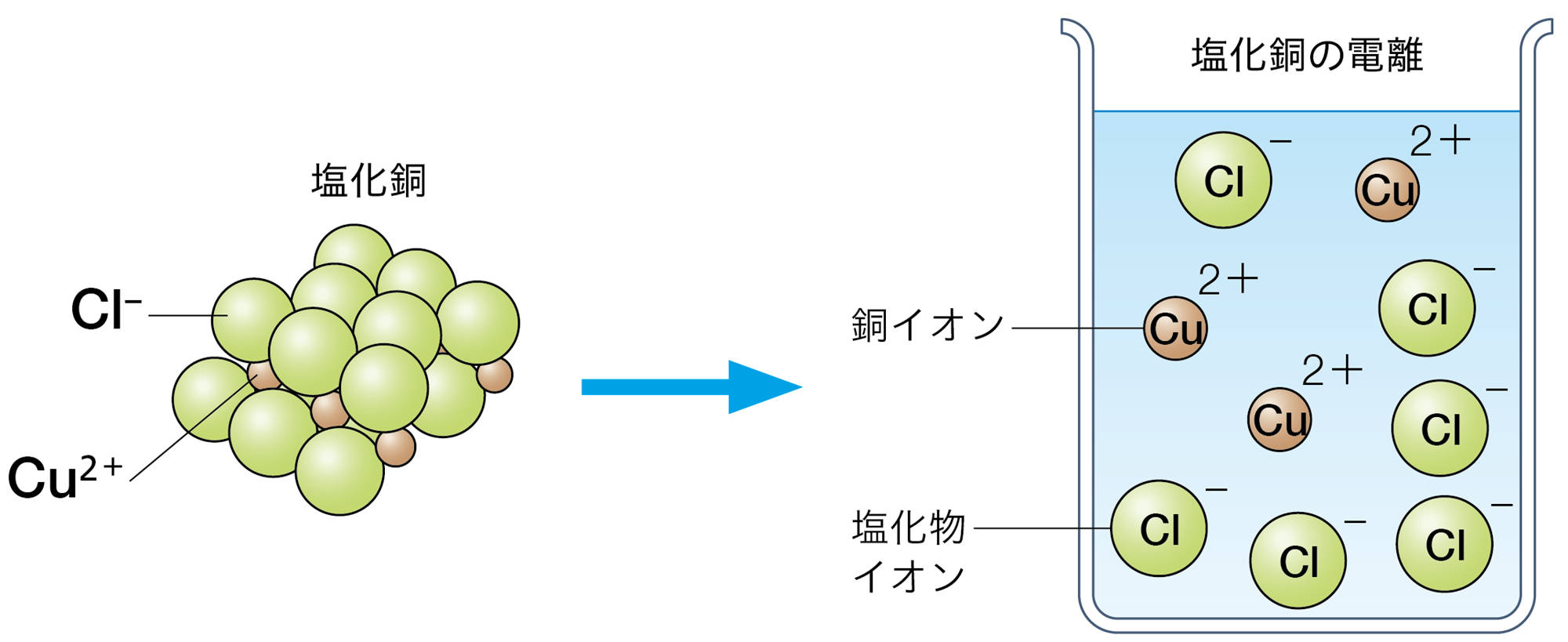
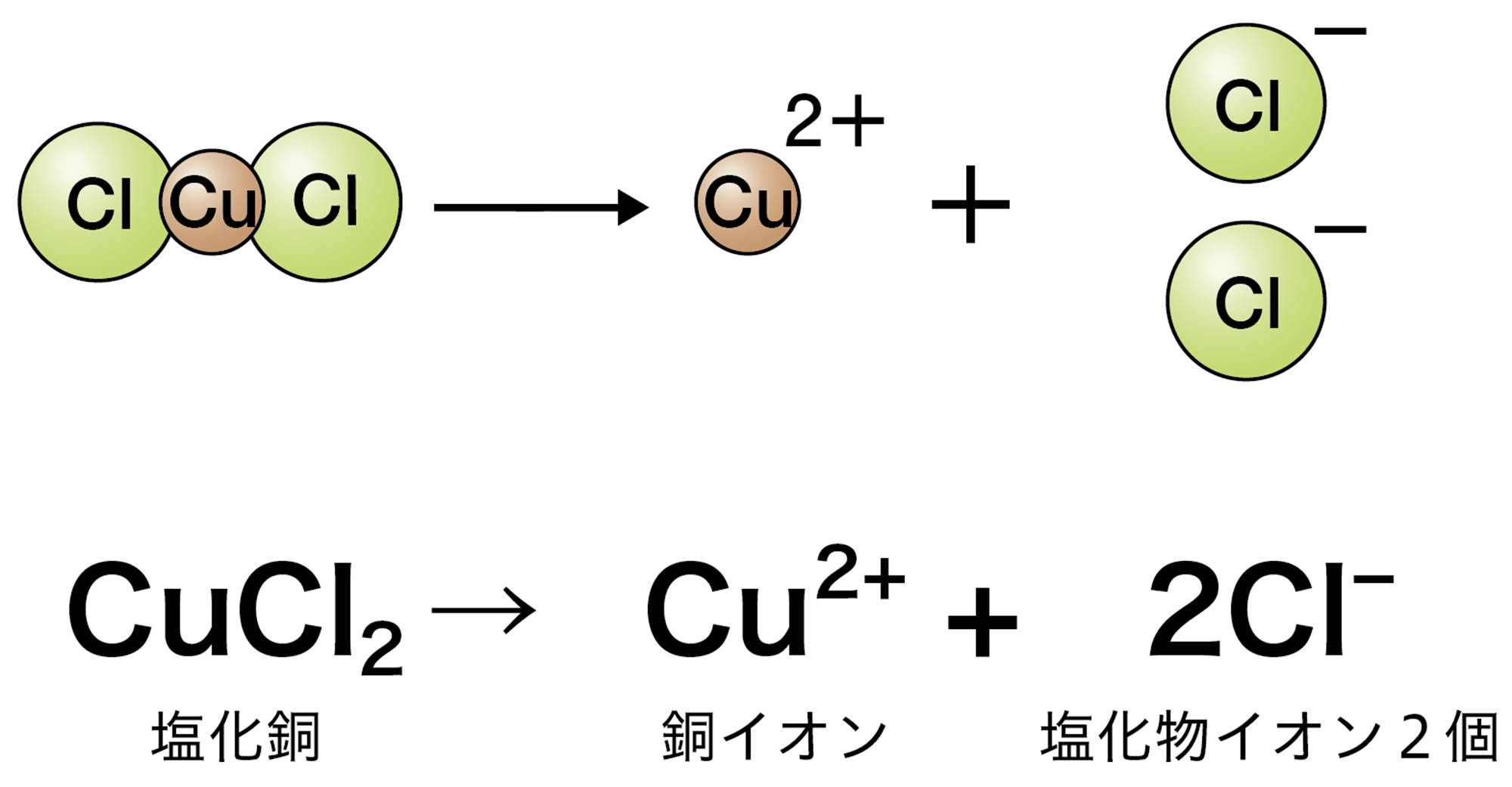
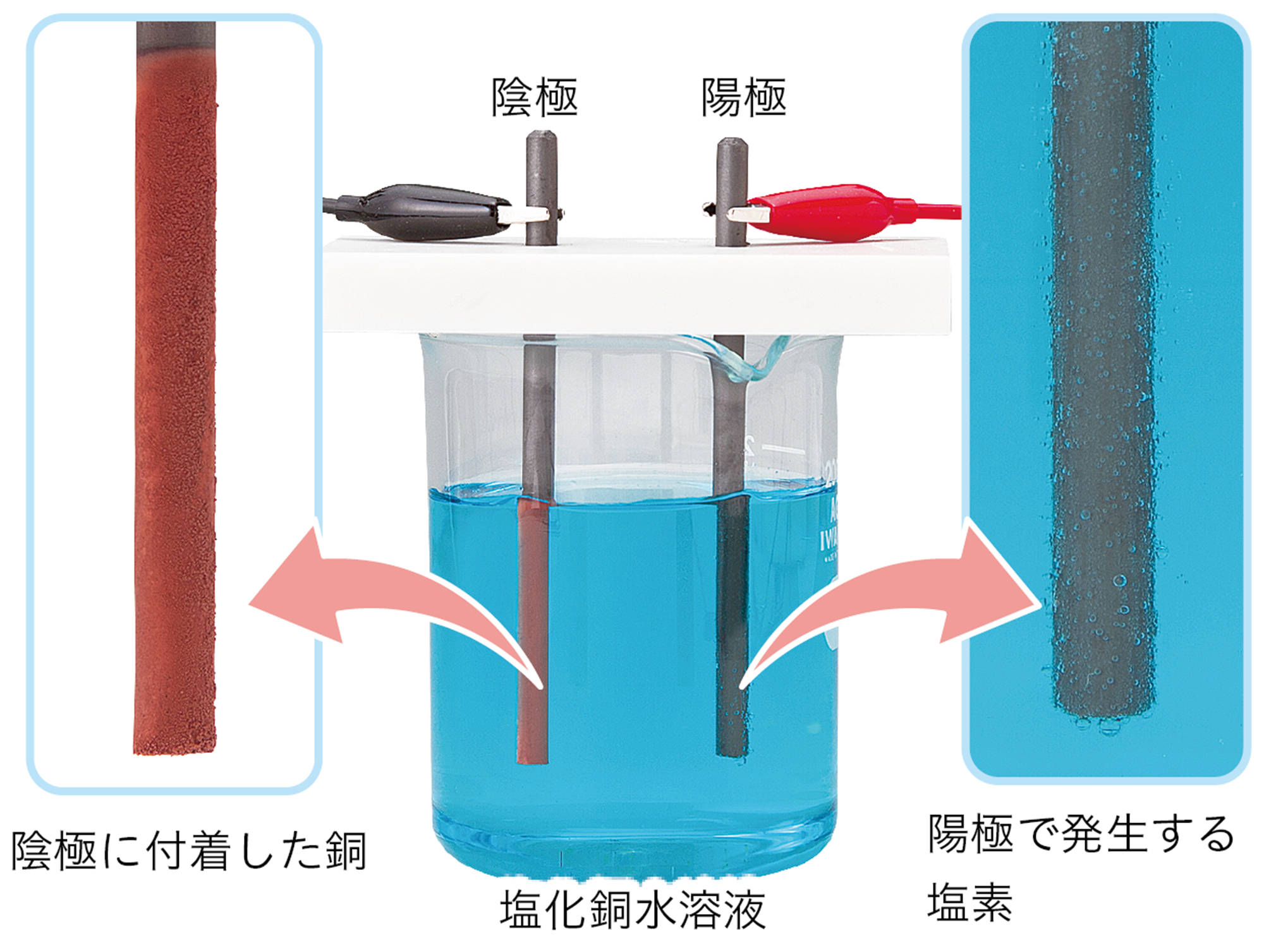
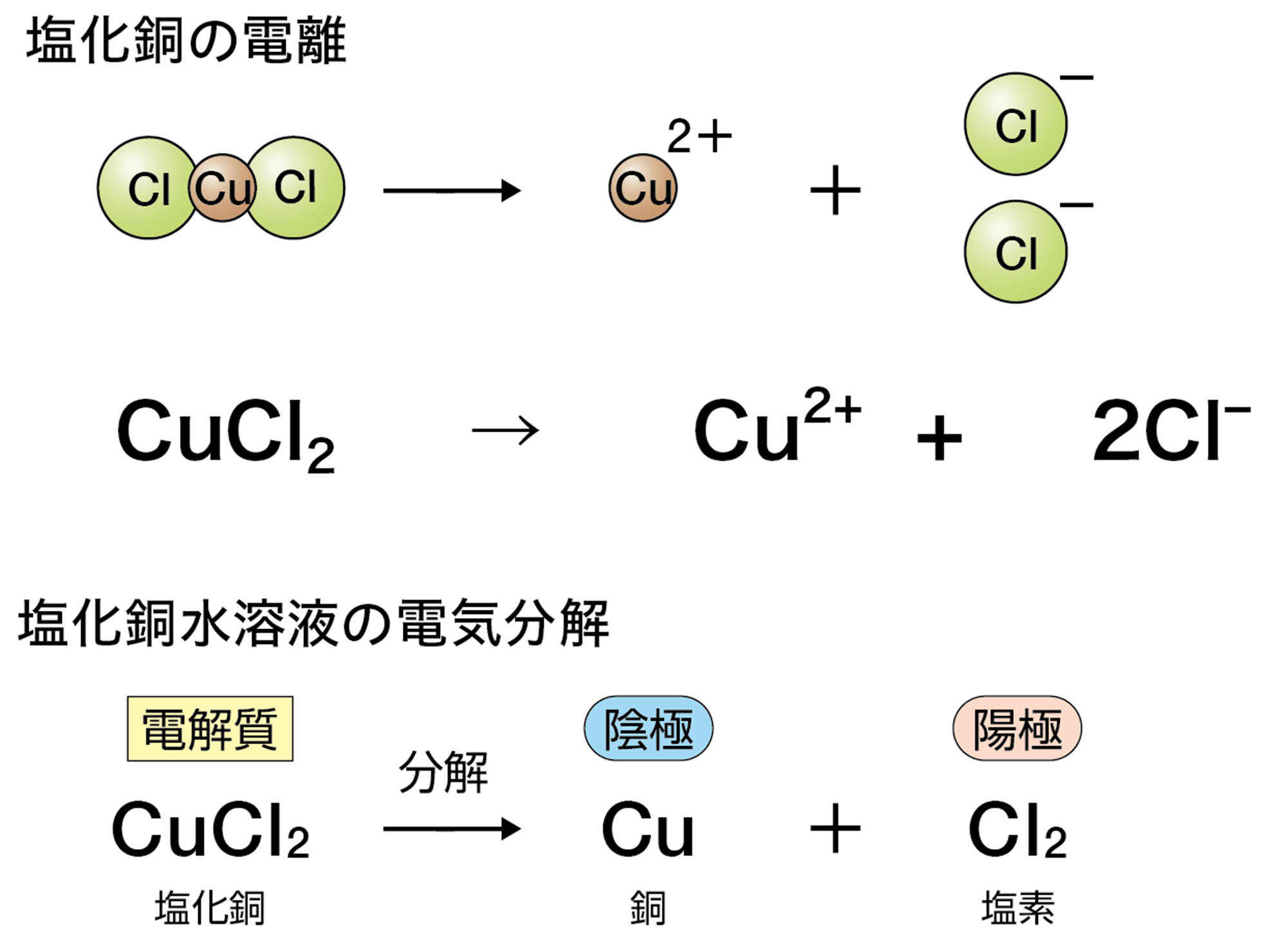
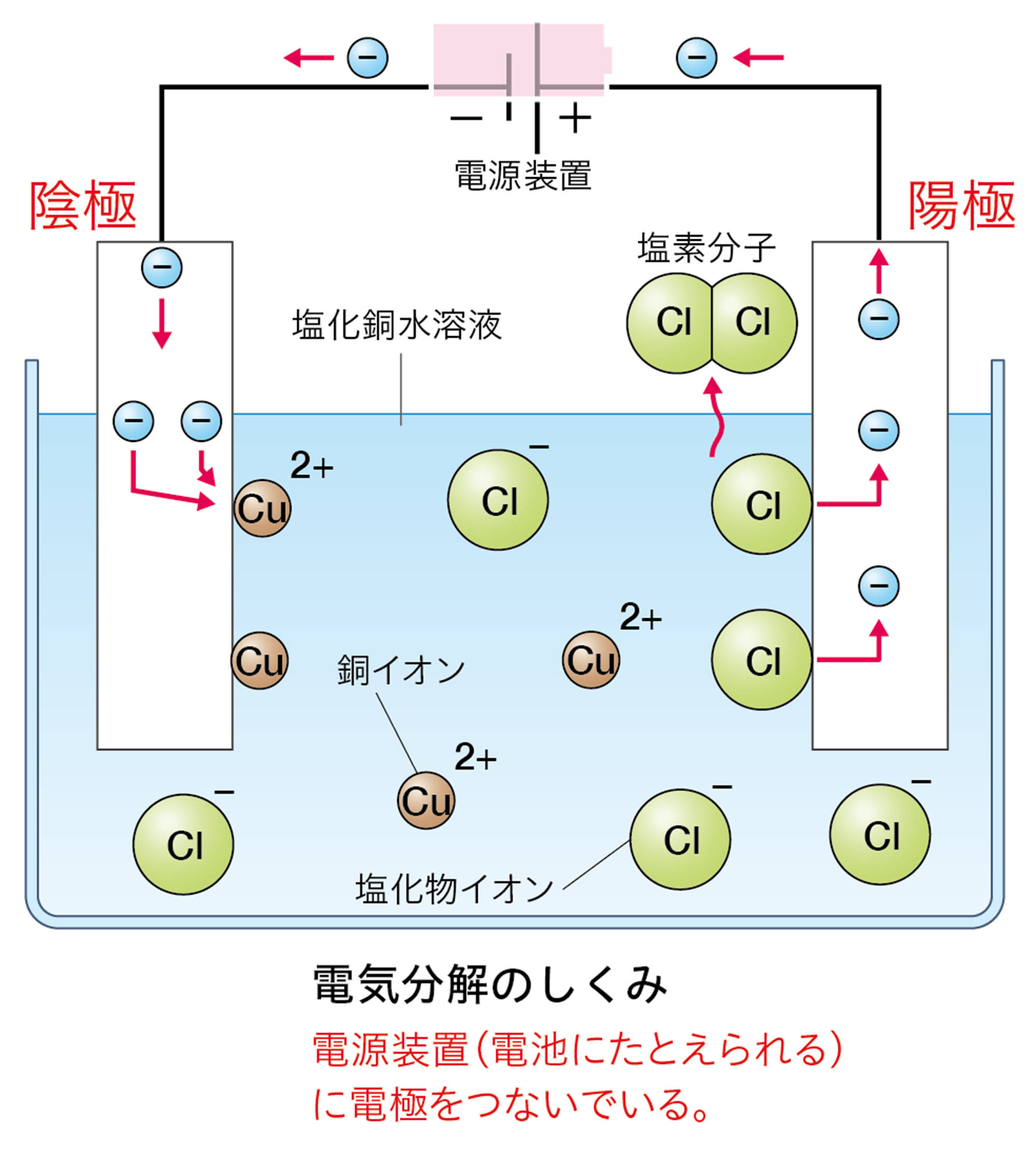
塩化銅CuCl₂は水に溶かすと次のように電離する。
CuCl₂ → Cu²⁺ + 2Cl⁻
この水溶液に電極を入れて電流を流したとき,電源装置の−極から電子が流れ出し,陰極に流れこむ。
水溶液中の銅イオンCu²⁺は,陰極で電源装置の−極から流れてきた電子2個を受け取って銅原子Cuになる。そのときのようすはイオンの化学式を使って次のように表す。
Cu²⁺ + 2e− → Cu
水溶液中の塩化物イオンCl⁻は,陽極で電子1個を放出して塩素原子Clになる。そのときのようすはイオンの化学式を使って次のように表す。
Cl⁻ → Cl + e−
塩素原子2個が結びついて塩素分子Cl₂になる。また,放出された電子は陽極から電源装置の+極に向かって流れる。

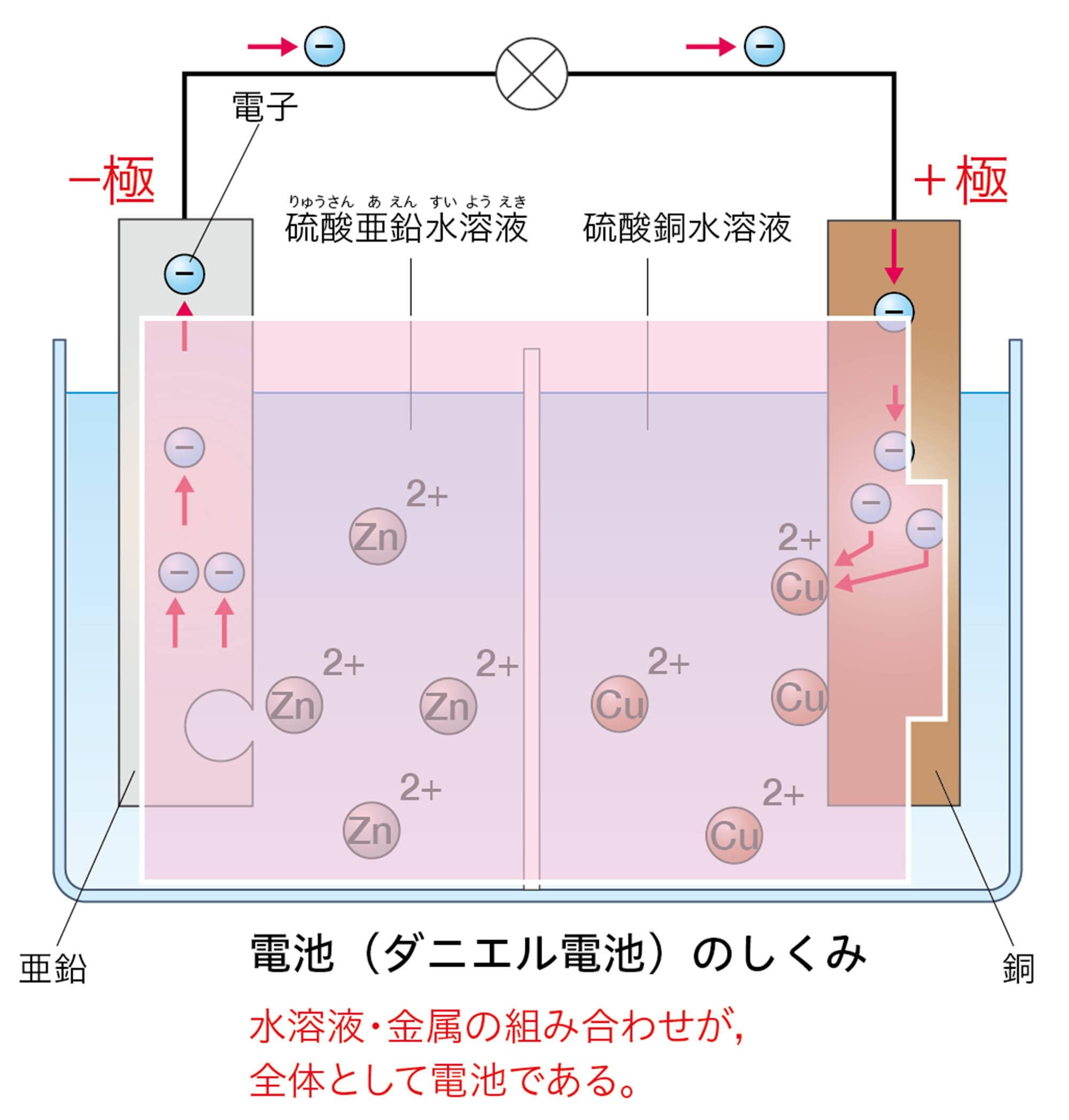
「電気分解のしくみ」を「電池」とまちがえやすいのですが,下のように異なります。電池では,電子が流れこむ方が「+極」,電子が流れ出す方が「−極」です。電気分解では,電池の+極に接続した電極が「陽極」,−極に接続した電極が「陰極」です。
電子の流れ,電極での電子のやり取りのちがいに注目しましょう。

※このウェブページは中学校理科3年の学習内容です。<3年p.262>
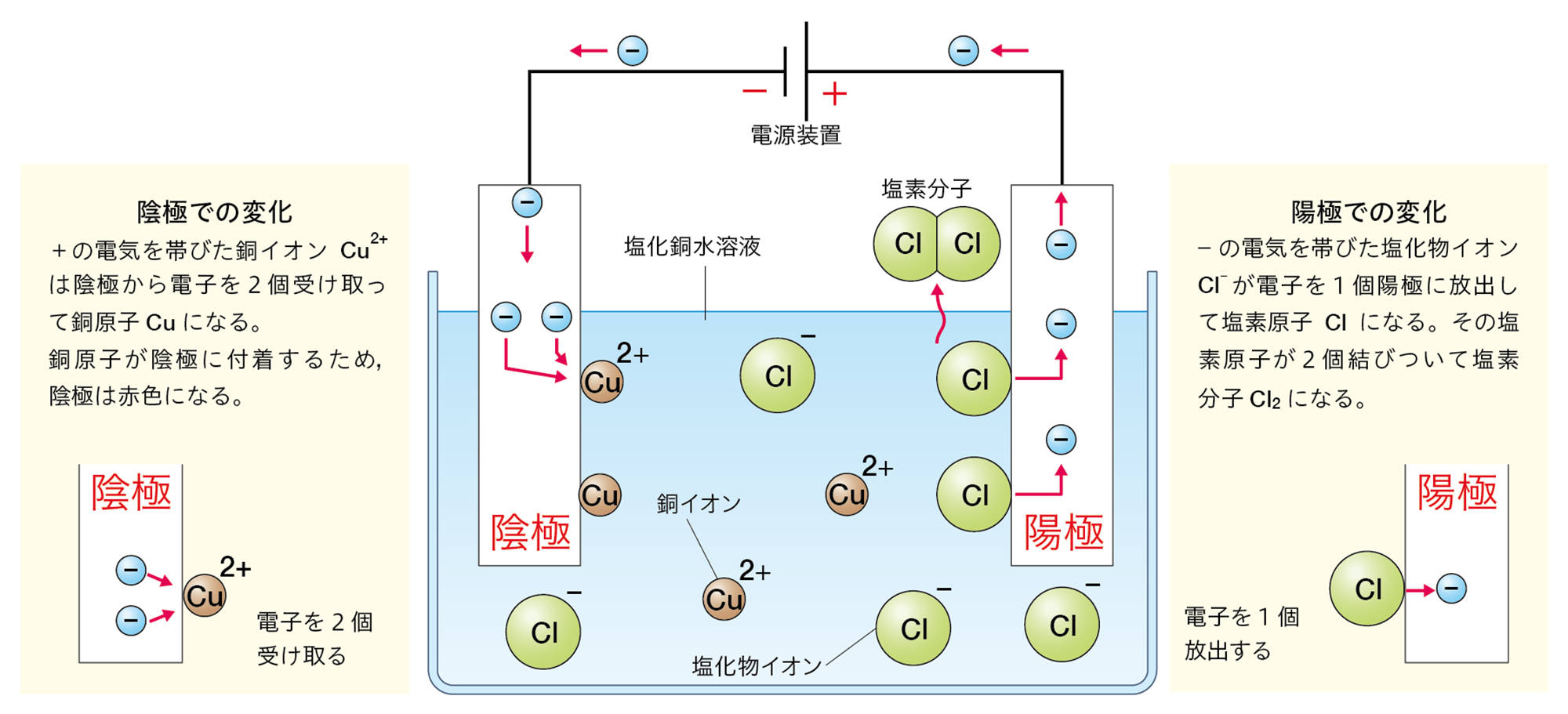
発展 塩化銅水溶液の電気分解のとき,陽極でなぜCl₂が発生するか
塩化銅水溶液の電気分解(p.121)で,水溶液中のCl⁻が陽極でCl₂になるとき,電子の性質が関わっている。
●電子殻
原子を構成している電子は,原子核を中心とするいくつかの層に分かれて存在している。この層を「電子殻」といい,各電子殻に入ることができる電子の数は決まっている。
たとえば,ナトリウム原子Naの最も外側の電子殻には電子が1個しかないので,この電子を放出してNa⁺になりやすい。塩素原子Clの最も外側の電子殻には電子が7個あるが,ここには電子は8個まで入れるので,電子を1個受け取ってCl⁻になりやすい。
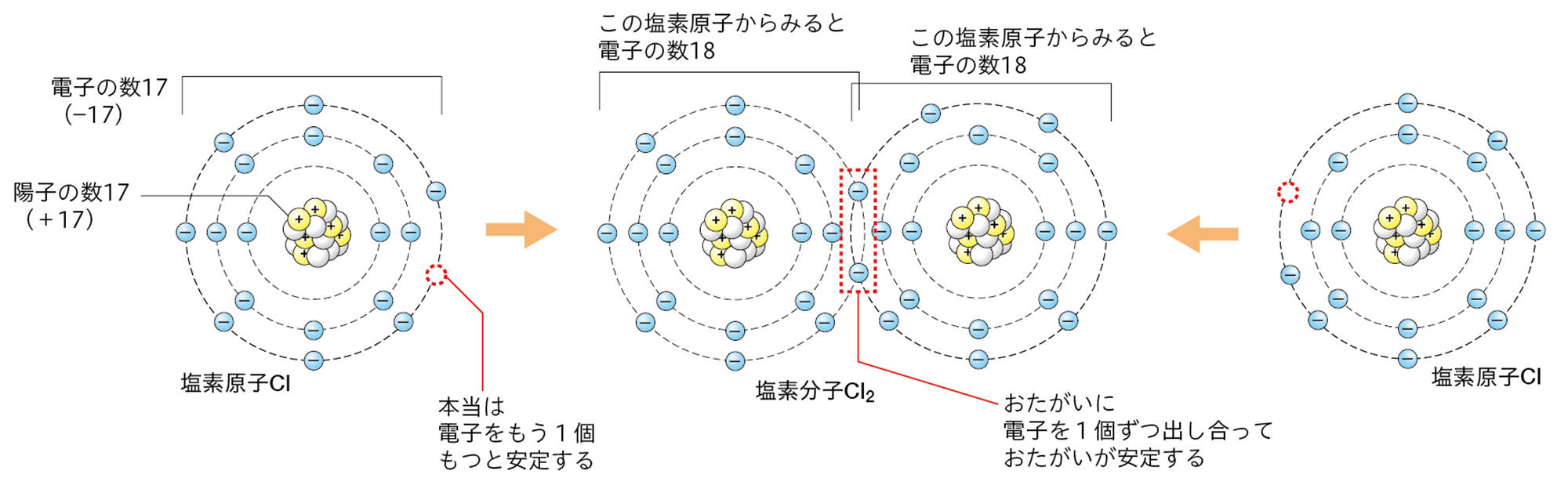
●Cl₂分子のできかた
塩化銅水溶液を電気分解すると,水溶液中のCl⁻は陽極で電子を1個放出して,塩素原子Clになる。
塩素原子は,最も外側の電子殻に7個の電子をもち,電子が8個のときに安定する。このような状態の塩素原子が2個あったとき,2個の塩素原子が1つずつ電子を共有して,安定した1個の塩素分子Cl₂になる。
つまり,塩化銅水溶液の電気分解のとき,陽極で塩化物イオンが塩素原子の状態になると,そのままでは安定ではなく,塩素原子2個が結びついてしまったほうが安定する。これが,陽極でCl₂が発生する理由である。
原子には,いくつかの原子が電子を共有して結びつくことで安定する性質がある。電子を共有して原子どうしが結びついたまとまりが,分子である。