gkt-horizontal-line
※このウェブページは中学校理科3年の学習内容です。<3年p.126>
2|イオンの化学式
1 陽イオン・陰イオン
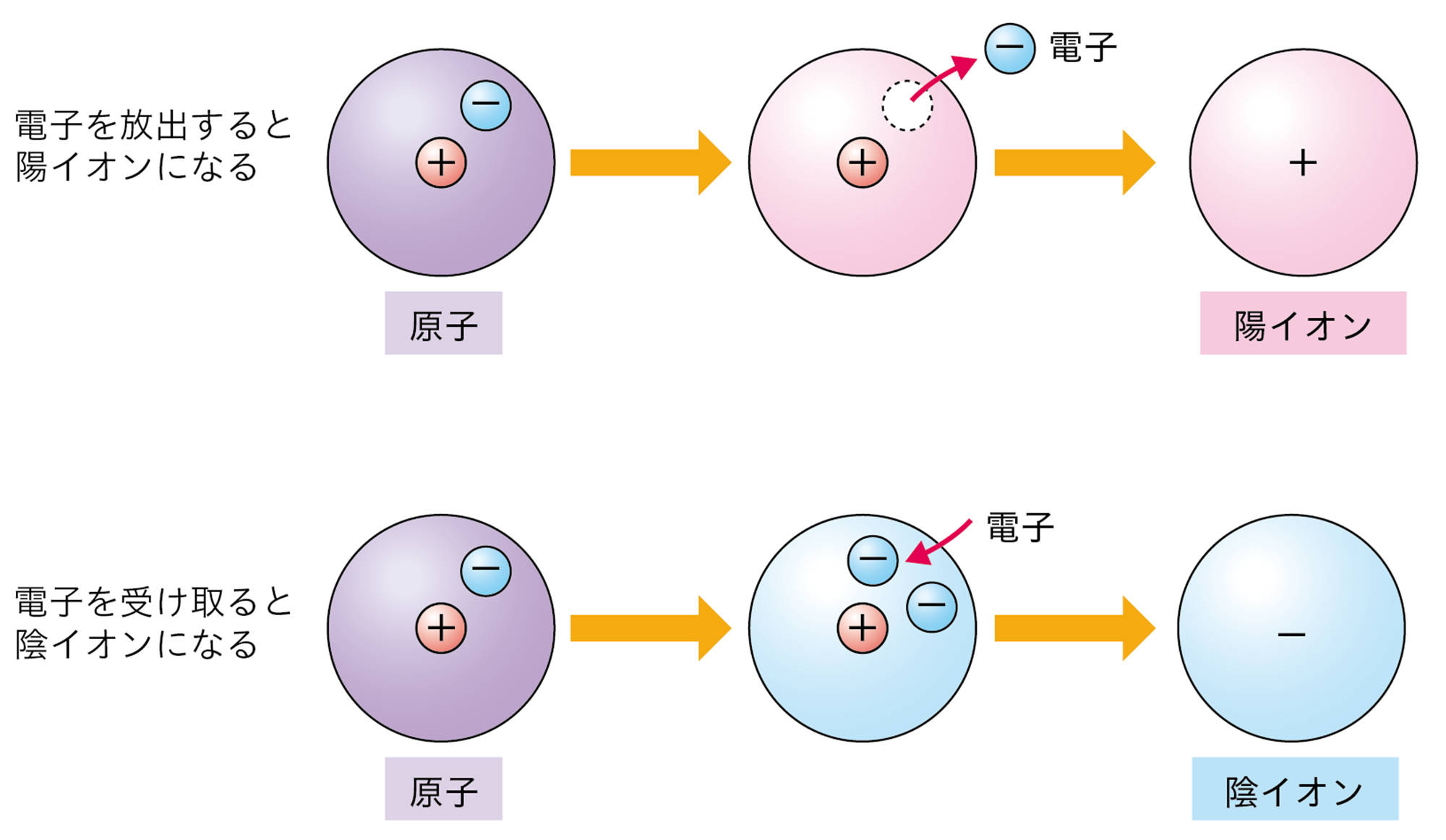
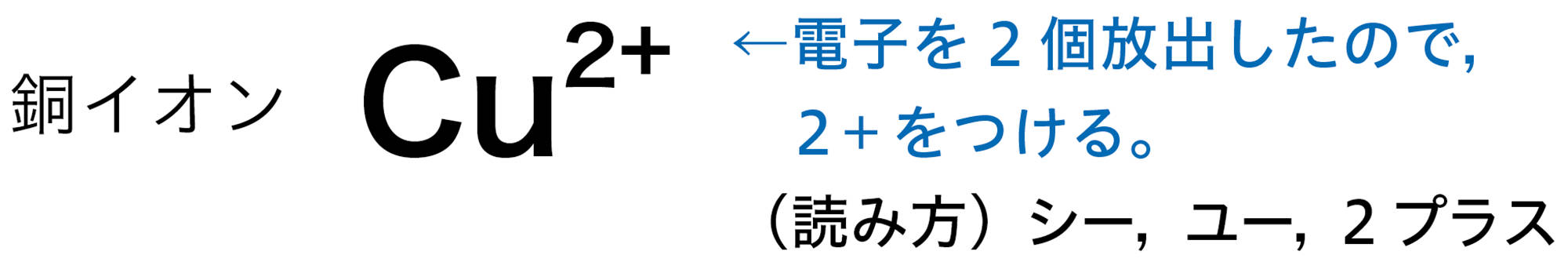
原子は自らの電子を放出したり,ほかの原子から電子を受け取ったりすることがある。原子が電子を放出すると,原子全体は+の電気を帯びて,【陽イオン】になる。原子が電子を受け取ると,原子全体は − の電気を帯びて,【陰イオン】になる❶(図9)。
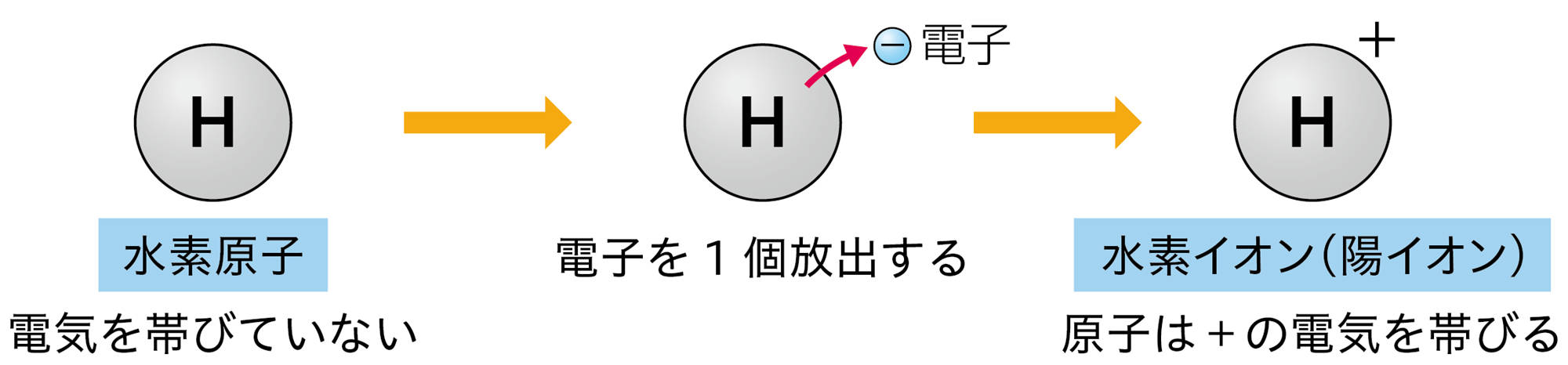
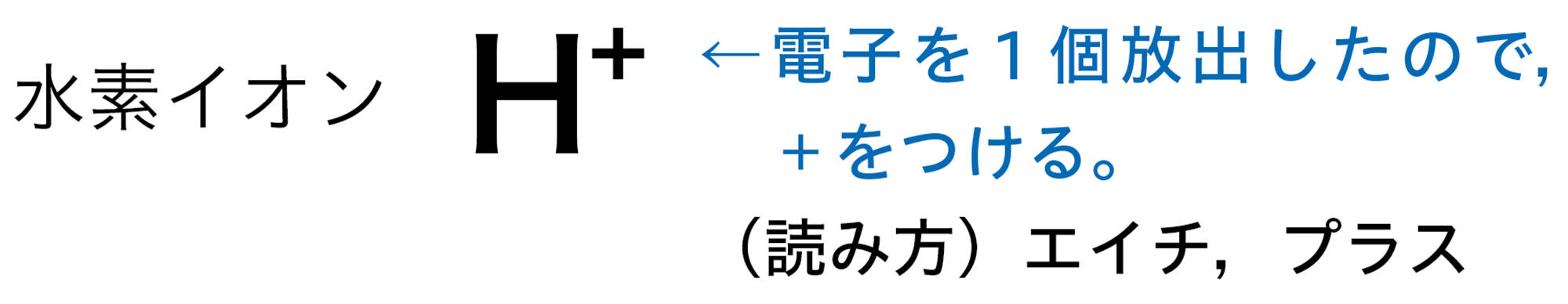
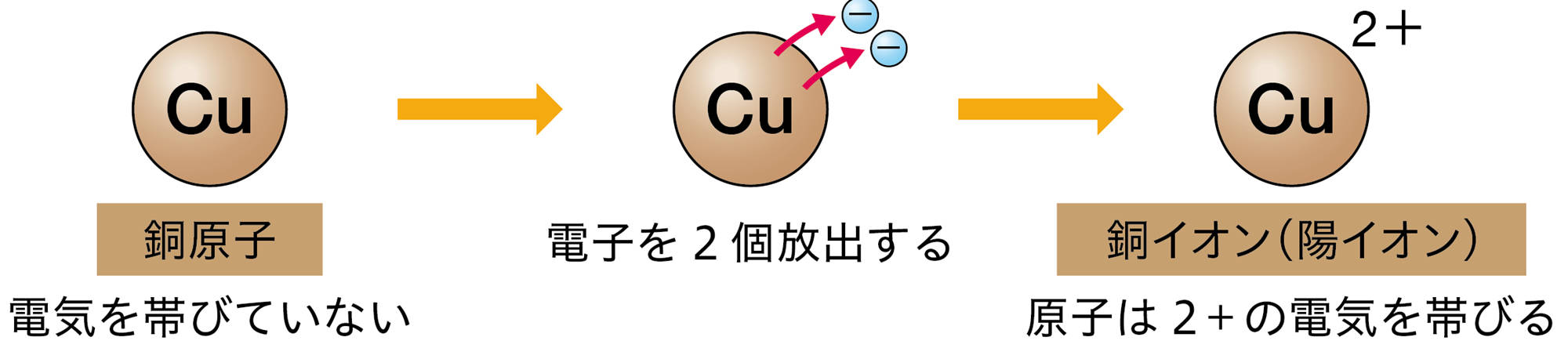
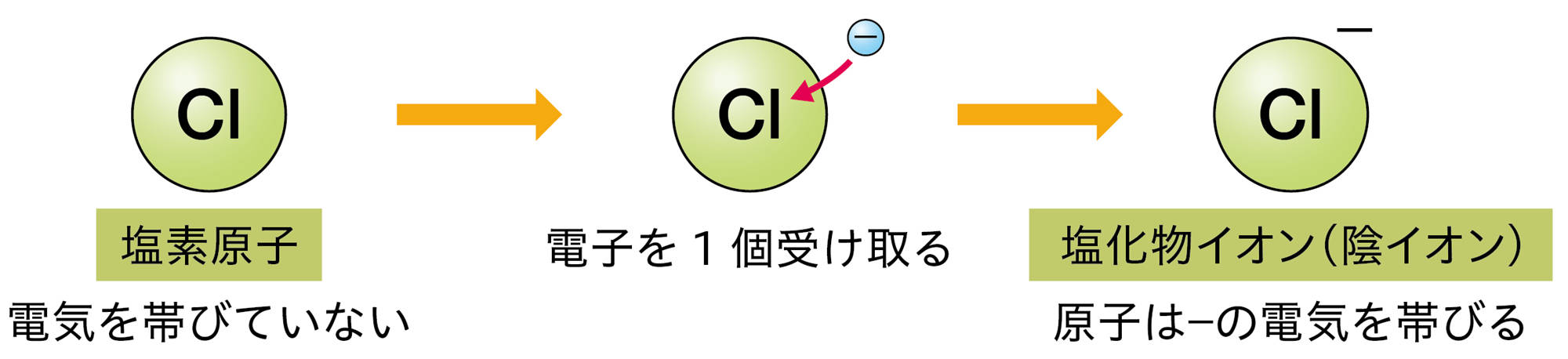
原子が放出したり,受け取ったりする電子の数は,原子の種類によって決まっている❷。たとえば,水素原子は1個の電子を放出して陽イオンに,塩素原子は1個の電子を受け取って陰イオンになる(図10)。
図10 原子がイオンになるときの表し方
❶ 「陽」とは「+」の意味,「陰」とは「−」の意味である。
❷ 原子の種類によって,もともともっている電子の数は決まっている。また,放出しやすい,受け取りやすい電子があり,際限なく電子を放出したり,受け取ったりするわけではない。