gkt-horizontal-line
※このウェブページは中学校理科3年の学習内容です。<3年p.137>
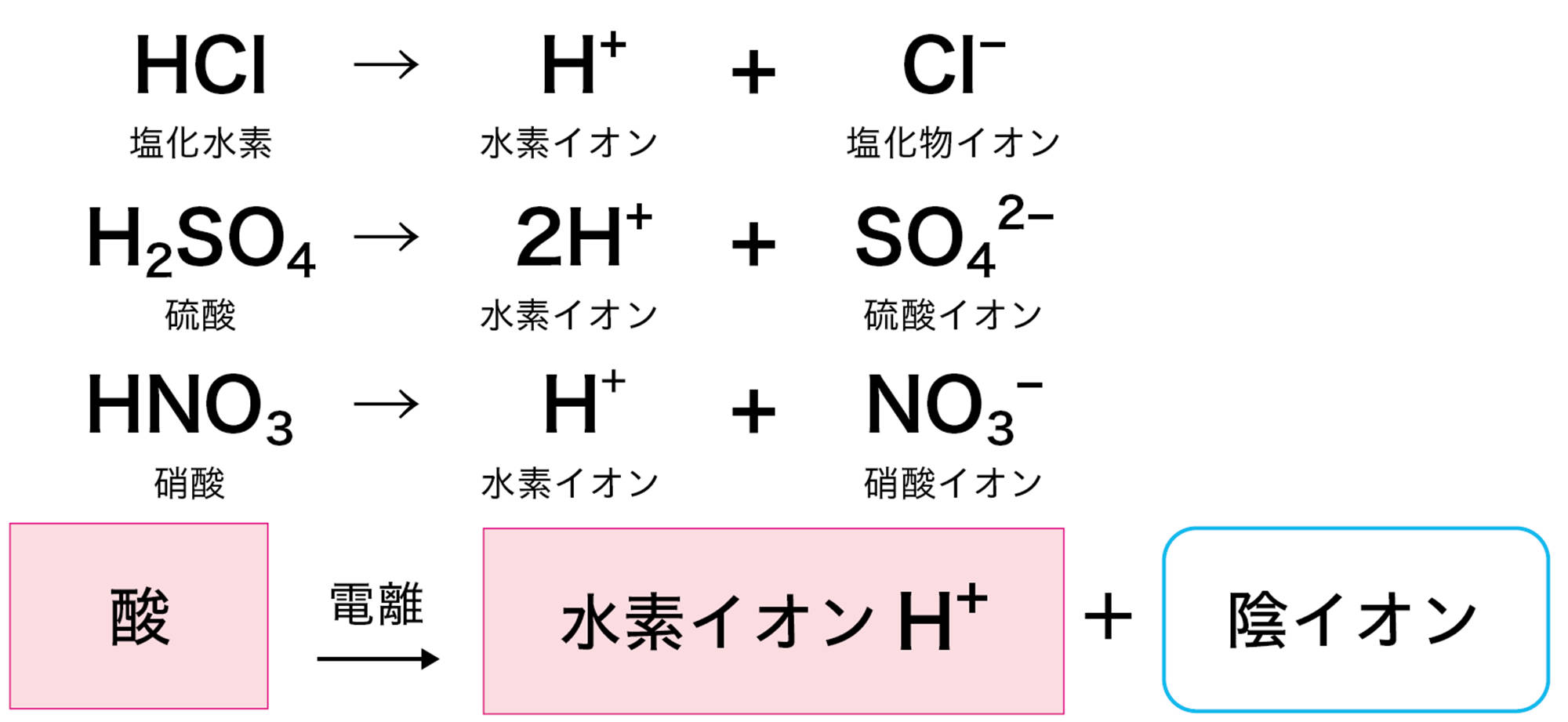
2 酸と水素イオン
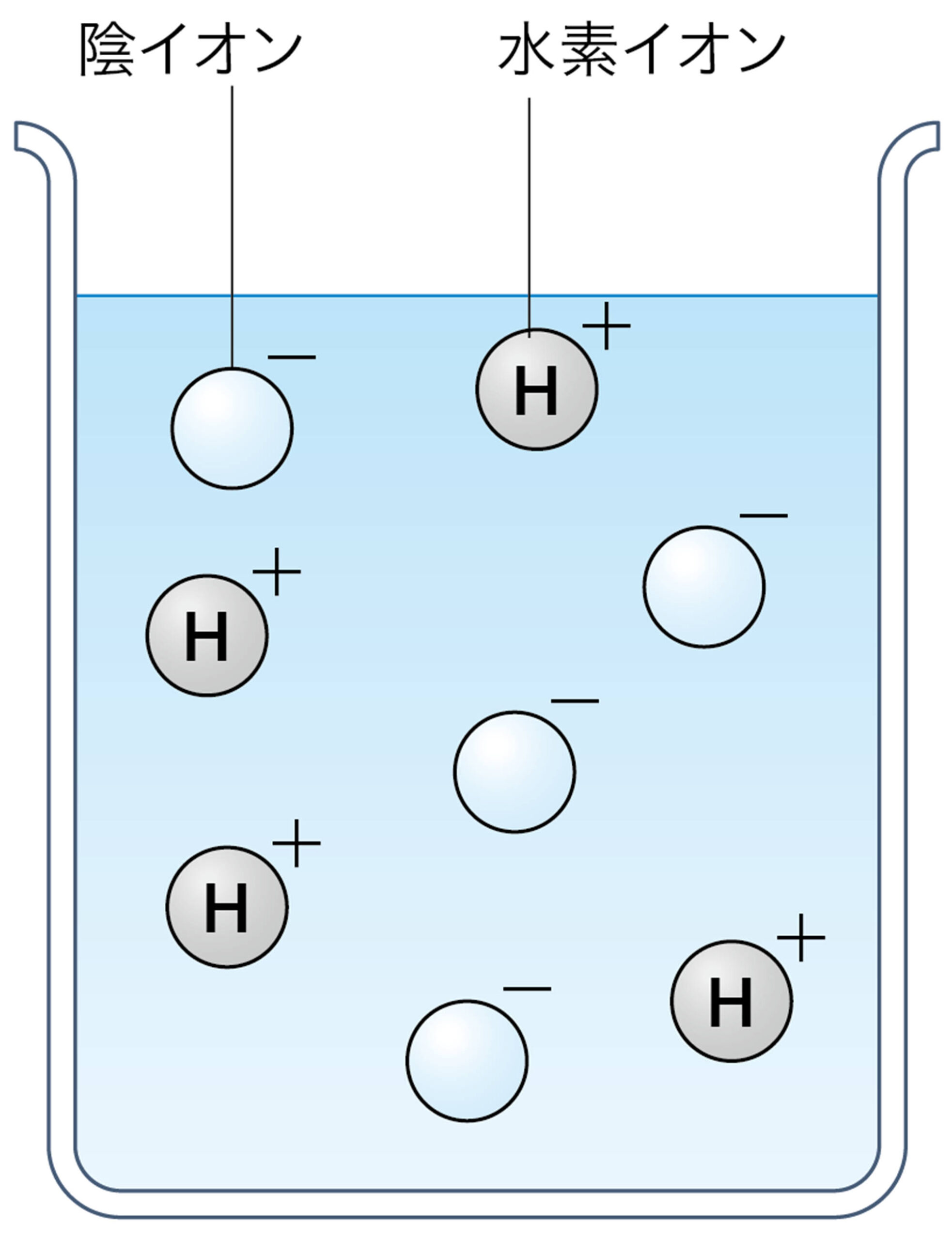
塩酸や硫酸が酸性を示すのは,水溶液中の水素イオンH⁺のはたらきである。つまり酸とは,水に溶けたとき電離して水素イオンH⁺を生じる化合物である(図6)。
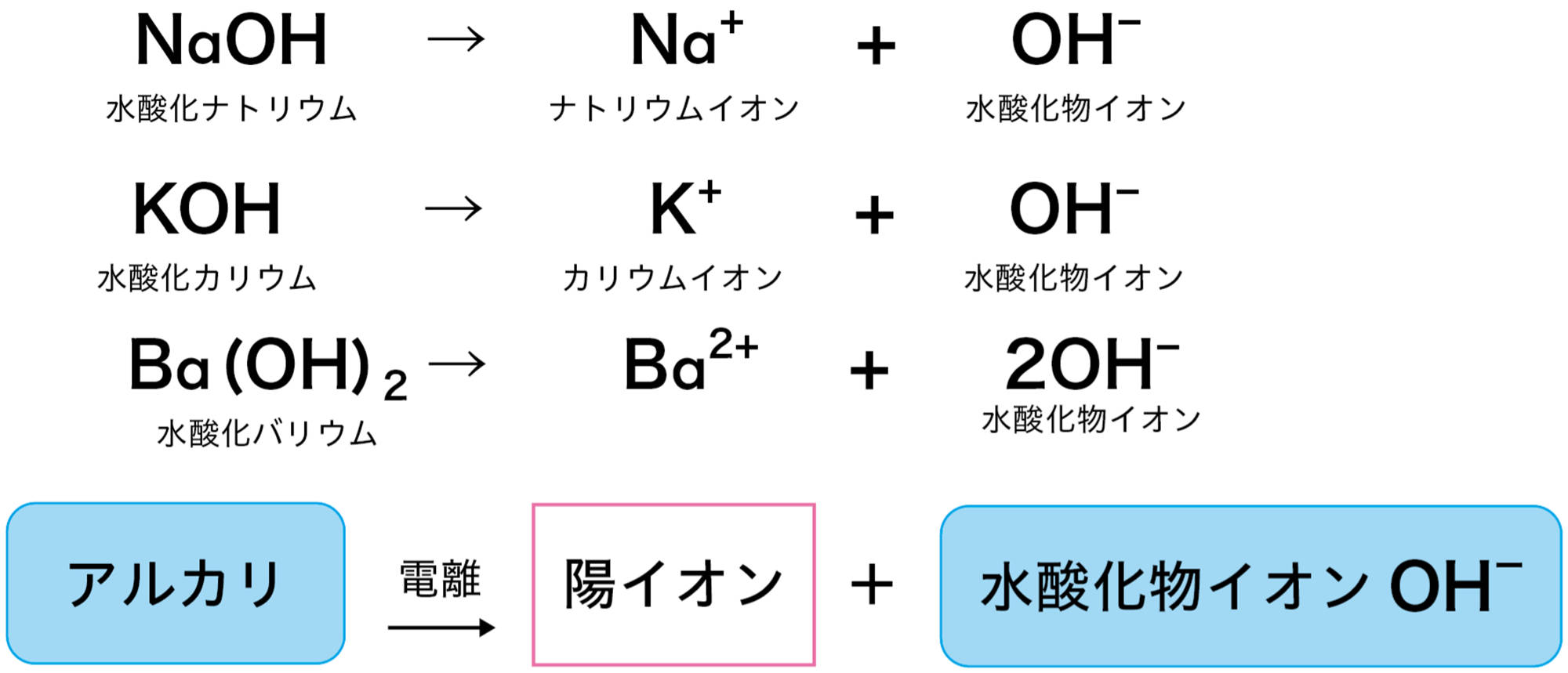
3 アルカリと水酸化物イオン
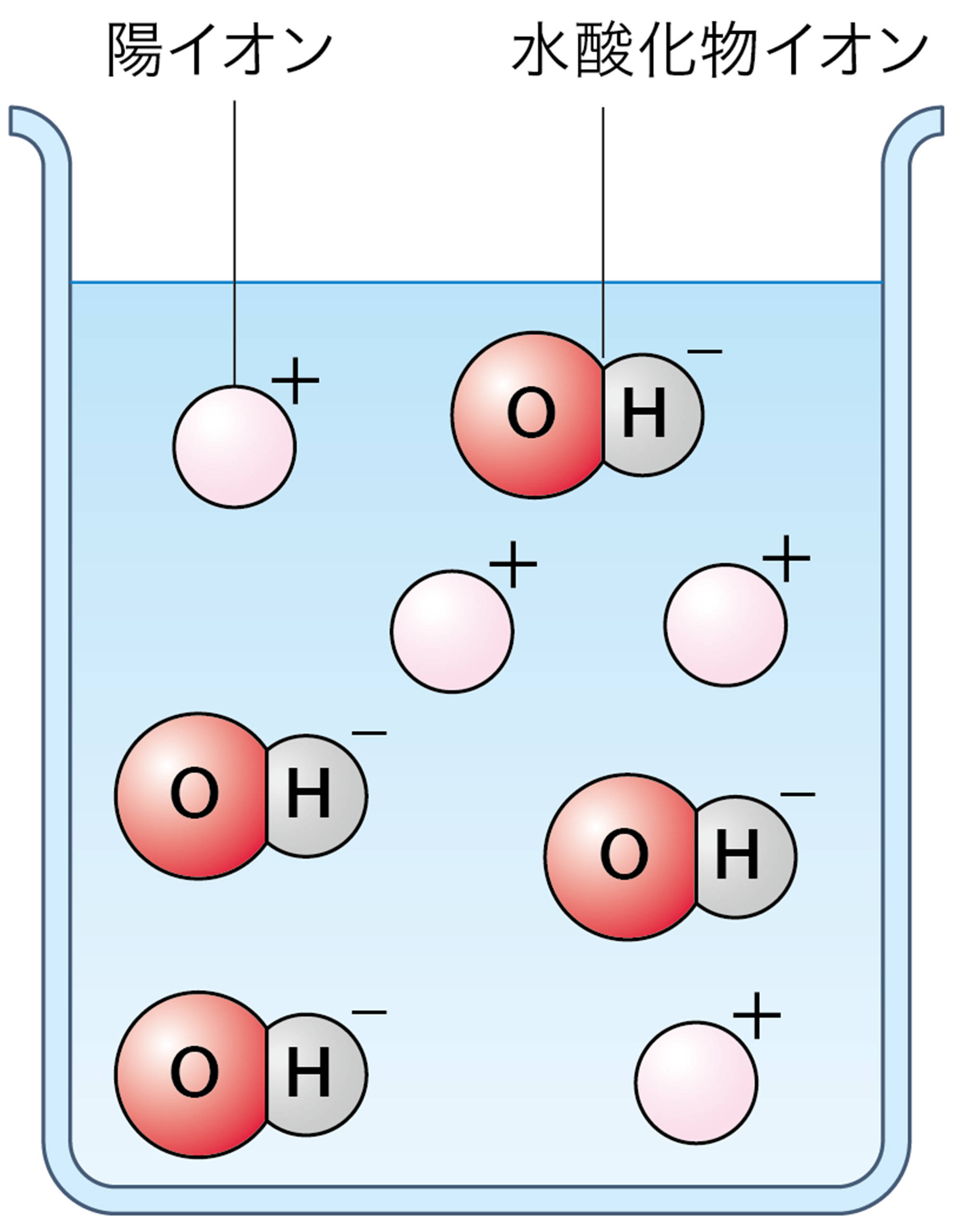
水酸化ナトリウム水溶液や水酸化カリウム水溶液がアルカリ性を示すのは,水溶液中の水酸化物イオンOH⁻のはたらきである。つまりアルカリとは,水に溶けたとき電離して水酸化物イオンOH⁻を生じる化合物である(図7)。