※このウェブページは中学校理科3年の学習内容です。<3年p.139>
2|中和
図10のように,酸性の水溶液にアルカリ性の水溶液を加えると,酸性の性質が弱くなってゆく。このしくみについて,どのように科学的に探究できるだろうか。
探究4 酸とアルカリを混ぜ合わせる

実験で使った酸を捨てるときは,図11のようにアルカリを混ぜて,アルカリを捨てるときは酸を混ぜるんですね。どうしてですか?
酸やアルカリをそのまま捨てると,環境に害があるからです。水酸化ナトリウムは皮ふについたら危険な物質ですし,金属によっては塩酸で溶けてしまいますよね。そういった強い薬品のはたらきを弱めてから捨てているのです。

図11 酸性,アルカリ性の水溶液を混ぜ合わせたときのpH試験紙の色の変化
どうして混ぜただけで,両方のはたらきがなくなるのかな?

塩酸と水酸化ナトリウム水溶液を混ぜ合わせると,水溶液の性質はどうなるか。

それぞれのイオンの化学式はなんだっけ。まず書いてみよう。
塩酸に水酸化ナトリウム水溶液を少しずつ加えて,水溶液の性質の変化を調べよう。

注意!!
保護めがねをかける。
水溶液の濃度は0.5%程度にする。
水溶液の実験はプラスチックバットの中で行う。
※このウェブページは中学校理科3年の学習内容です。<3年p.140>

電離のようすから,仮説を下のように考えました。
水溶液中から,酸性の正体である水素イオンも,アルカリ性の正体である水酸化物イオンもなくなっていくので,水溶液が中性になっていくと思います。

水溶液中でイオンのままの粒子もあるはずです。


酸性がだんだん弱くなっていくようすは,pHによって変化する試薬を使えば確かめることができる。
水が増えたことは確認できないね。もともと水があるから。


ナトリウムイオン,塩化物イオンが増えたことは確かめられるかな。
準備
塩酸(0.5%),水酸化ナトリウム水溶液(0.5%),BTB溶液,試験管(2),ビーカー(2),こまごめピペット,小さいスポイト,ガラス棒,スライドガラス,顕微鏡またはルーペ,ドライヤー(またはホットプレート),保護めがね
1.塩酸をとる

こまごめピペットの先を上に向けないように注意しましょう。ゴム球に液が入ってゴム球がいたんでしまいます。
※このウェブページは中学校理科3年の学習内容です。<3年p.141>
2.水酸化ナトリウム水溶液を加えていく
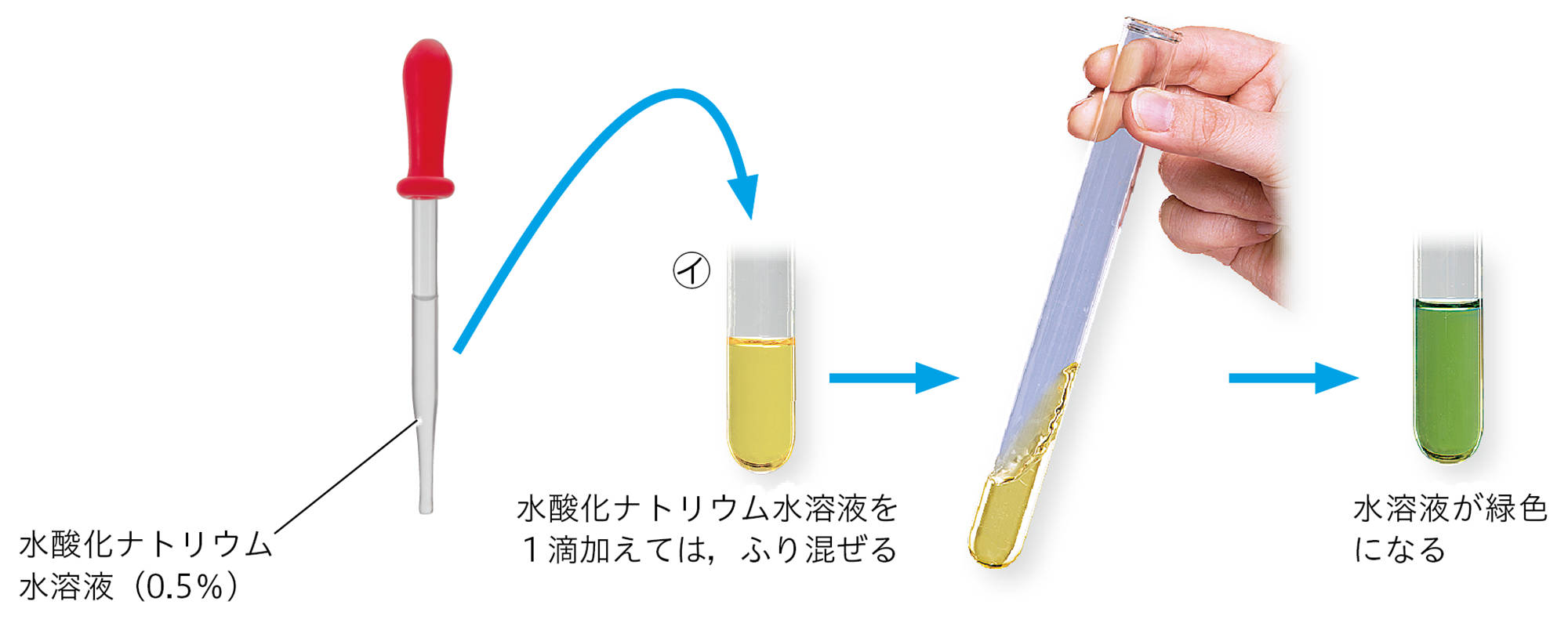
試験管 ㋐ に,水酸化ナトリウム水溶液を1cm³ずつ加えては,試験管をふり混ぜ,色の変化のようすを見る。水溶液が青色(アルカリ性)になったところでやめる。
このとき,何cm³(たとえば6cm³)で水溶液が青色になったか記録しておく。
3.水溶液を中性にする
試験管 ㋑ に,水溶液が青色に変化する直前まで(たとえば5cm³),こまごめピペットで水酸化ナトリウム水溶液を加える。
次に小さいスポイトで水酸化ナトリウム水溶液を1滴加えてはふり混ぜ,水溶液が緑色(中性)になったところでやめる。
ポイント
水溶液が緑色になるとき,一度青色になってから緑色に変化することがある。ふり混ぜたあとしばらくようすを見る。
4.蒸発させて観察する
中性になった水溶液を1滴スライドガラスに取り,乾燥させて現れた固体をルーペや顕微鏡で観察する。
ポイント
- 方法3で,水溶液の色はどのように変化したか。
- 方法4で観察した物質はどのような形をしていたか。
ポイント
- 水溶液の性質はどのように変化したといえるか。また,この化学変化で生じた物質は何か。
- この化学変化をイオンの化学式でどのように表すことができるか。
※このウェブページは中学校理科3年の学習内容です。<3年p.142>
探究4 結果から考察する
- BTB溶液を加えた塩酸に水酸化ナトリウム水溶液を加えていくと,水溶液の色は,黄色→緑色→青色 と変化した。
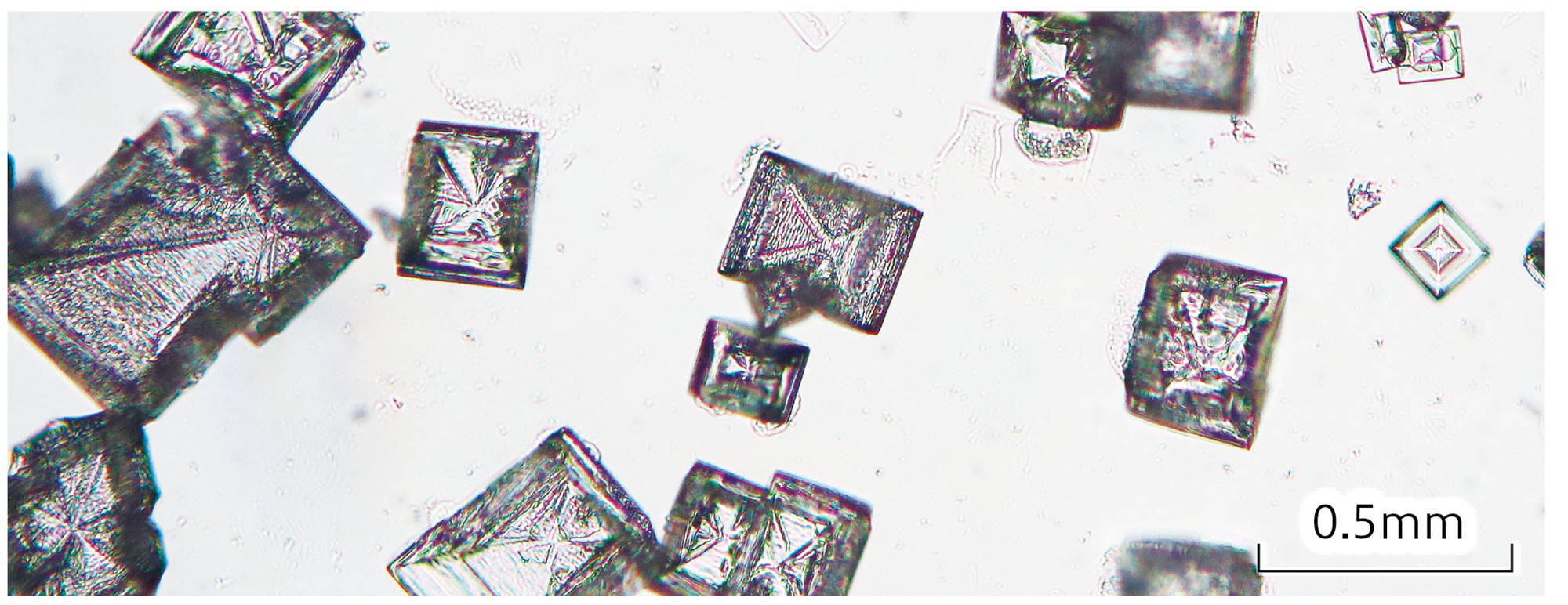
- 水酸化ナトリウム水溶液を加えて中性になった水溶液を少量とって水を蒸発させ,顕微鏡で観察すると,図12(b)のような結晶が見られた。
図12 探究4の結果例
- BTB溶液を加えた水溶液の色が黄色→緑色→青色と変化したことから,水溶液が酸性→中性→アルカリ性と変化していることがわかる。
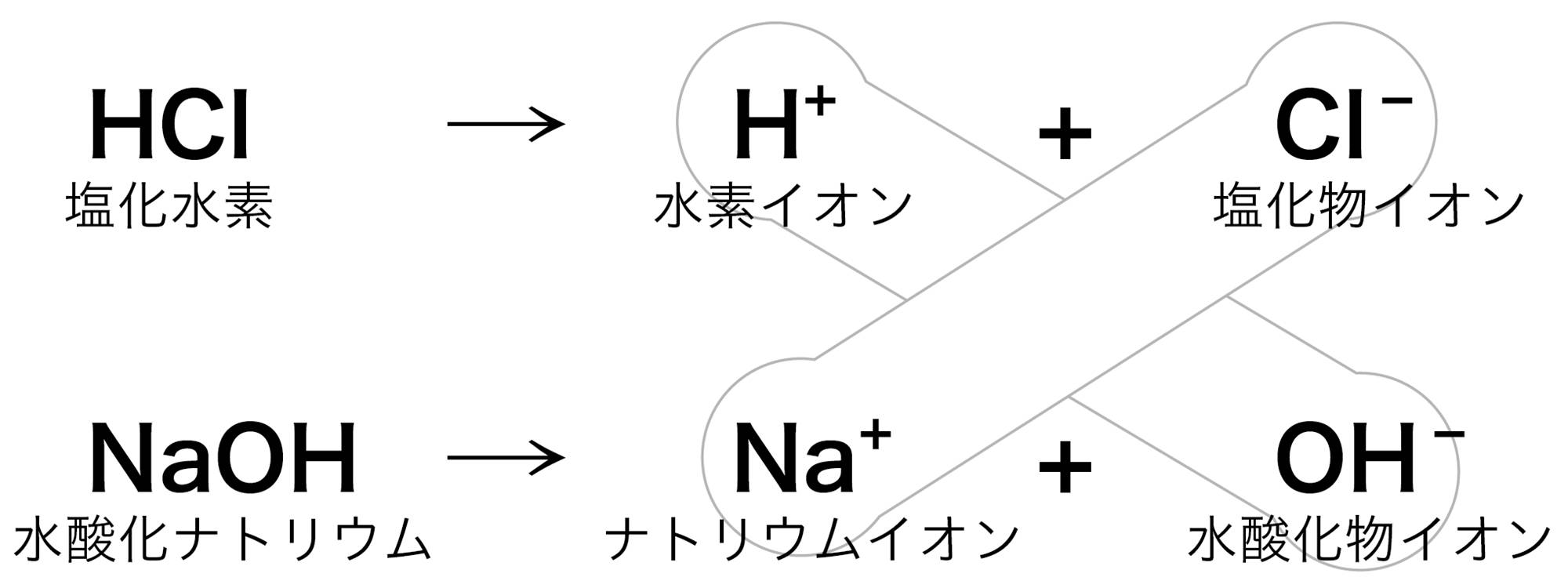
- 結晶の形から,できた物質は塩化ナトリウムであることがわかる。この結果から,イオンの化学式を使って図13のように考えられる。
- H+とOHーから水もできているのではないか。
※このウェブページは中学校理科3年の学習内容です。<3年p.143>
1 中和
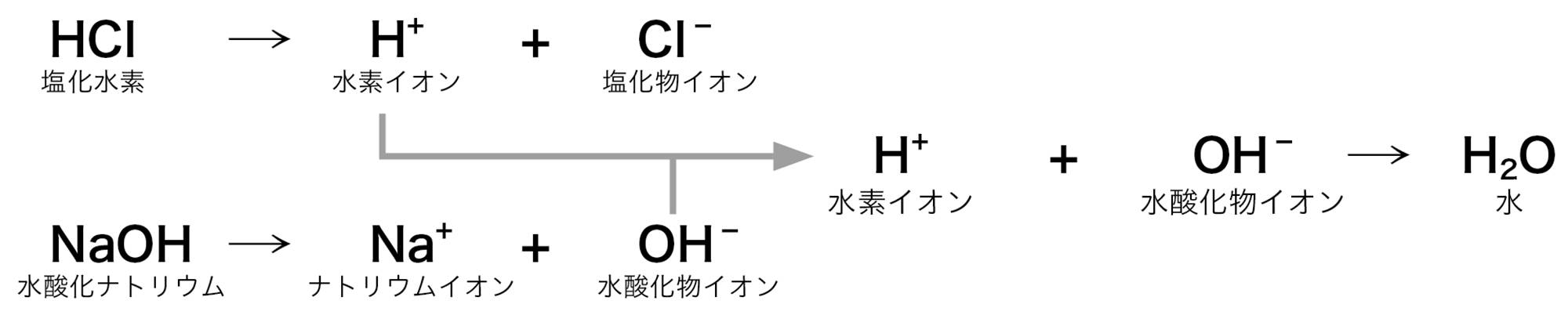
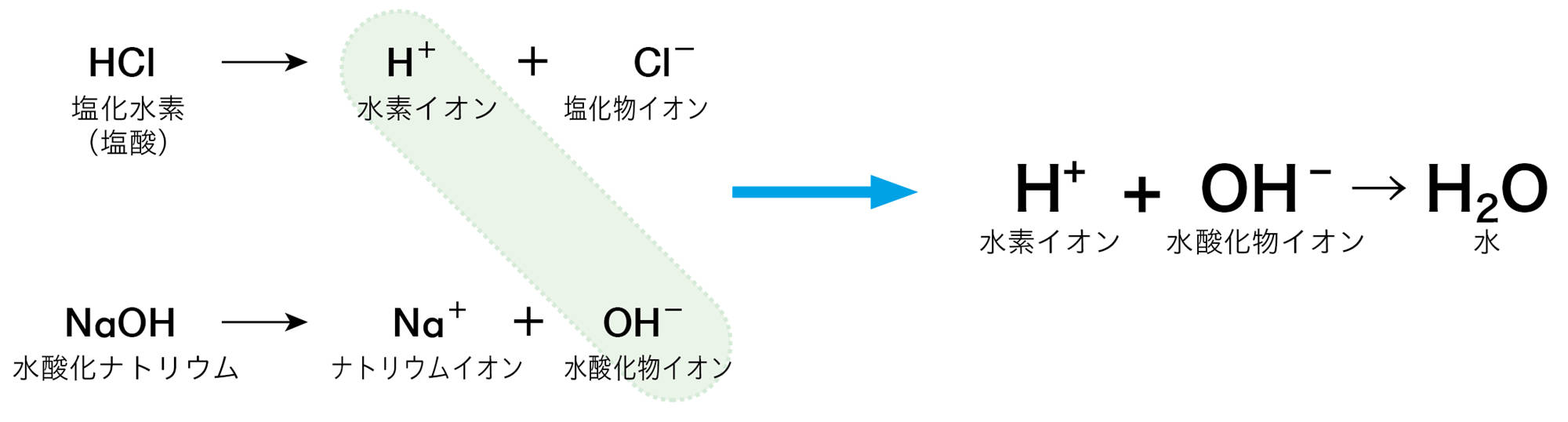
酸性の水溶液とアルカリ性の水溶液を混ぜると,たがいにその性質を打ち消し合う。このような化学変化を【中和】❶といい,このとき水ができる。中和は,酸の水素イオンH⁺とアルカリの水酸化物イオンH₂Oとが結びついて水HO⁻になる化学変化である(図14)。
水素イオンと水酸化物イオンは,もっている電気が異なるので,結びつくと電気を帯びていない状態になりますね。

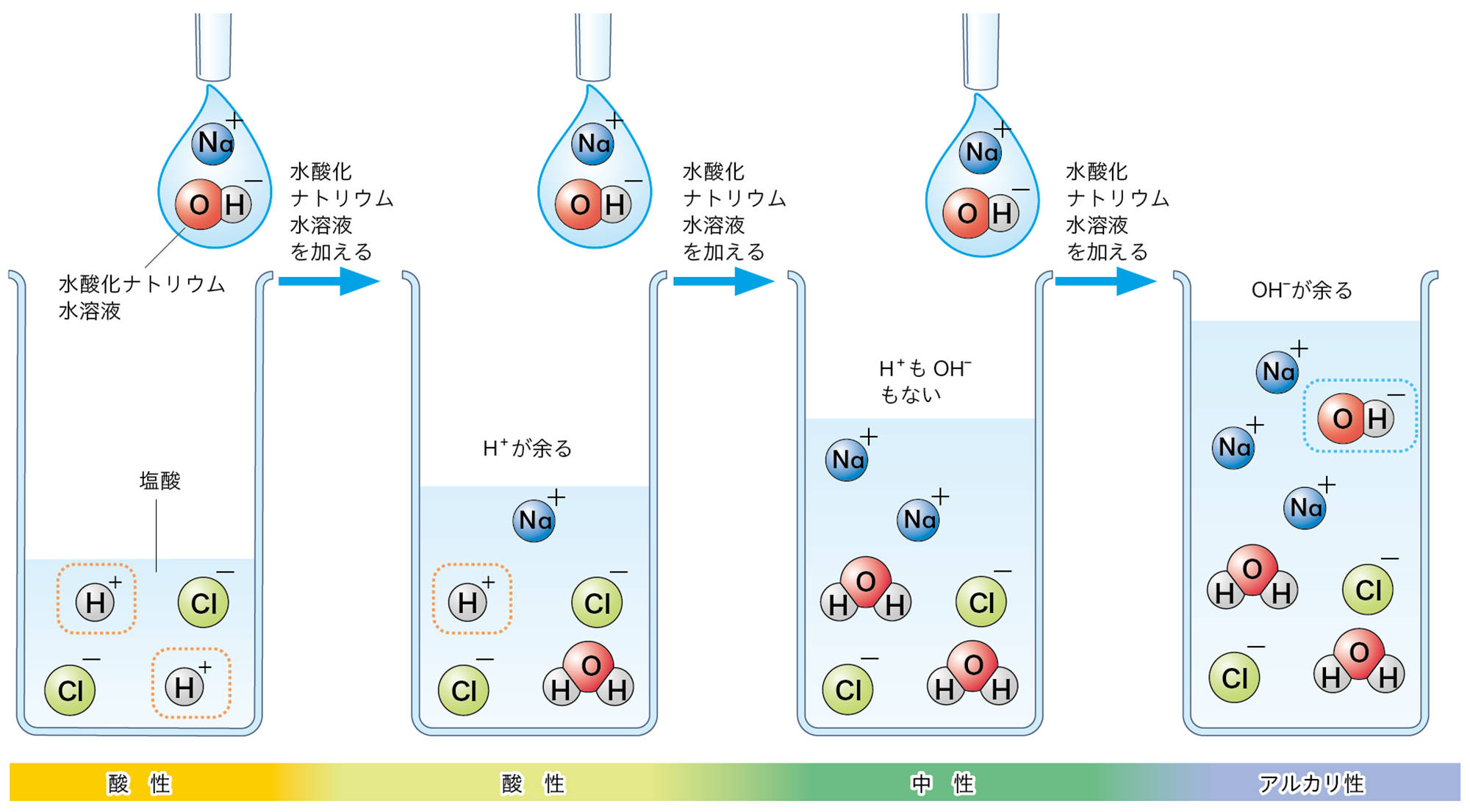
塩酸と水酸化ナトリウム水溶液を混ぜると中和が起こるが,混合液がいつも中性になるとは限らない。図15のように,水素イオンH⁺が余れば水溶液は酸性を示し,水酸化物イオンOH⁻が余れば水溶液はアルカリ性を示す。
中性にならなくても,中和は起こっていることに気をつけましょう。

❶ H⁺とOH⁻が同数で中和するとき,どちらも残らずに水ができて,酸性とアルカリ性が相互に完全に打ち消される。
※このウェブページは中学校理科3年の学習内容です。<3年p.144>
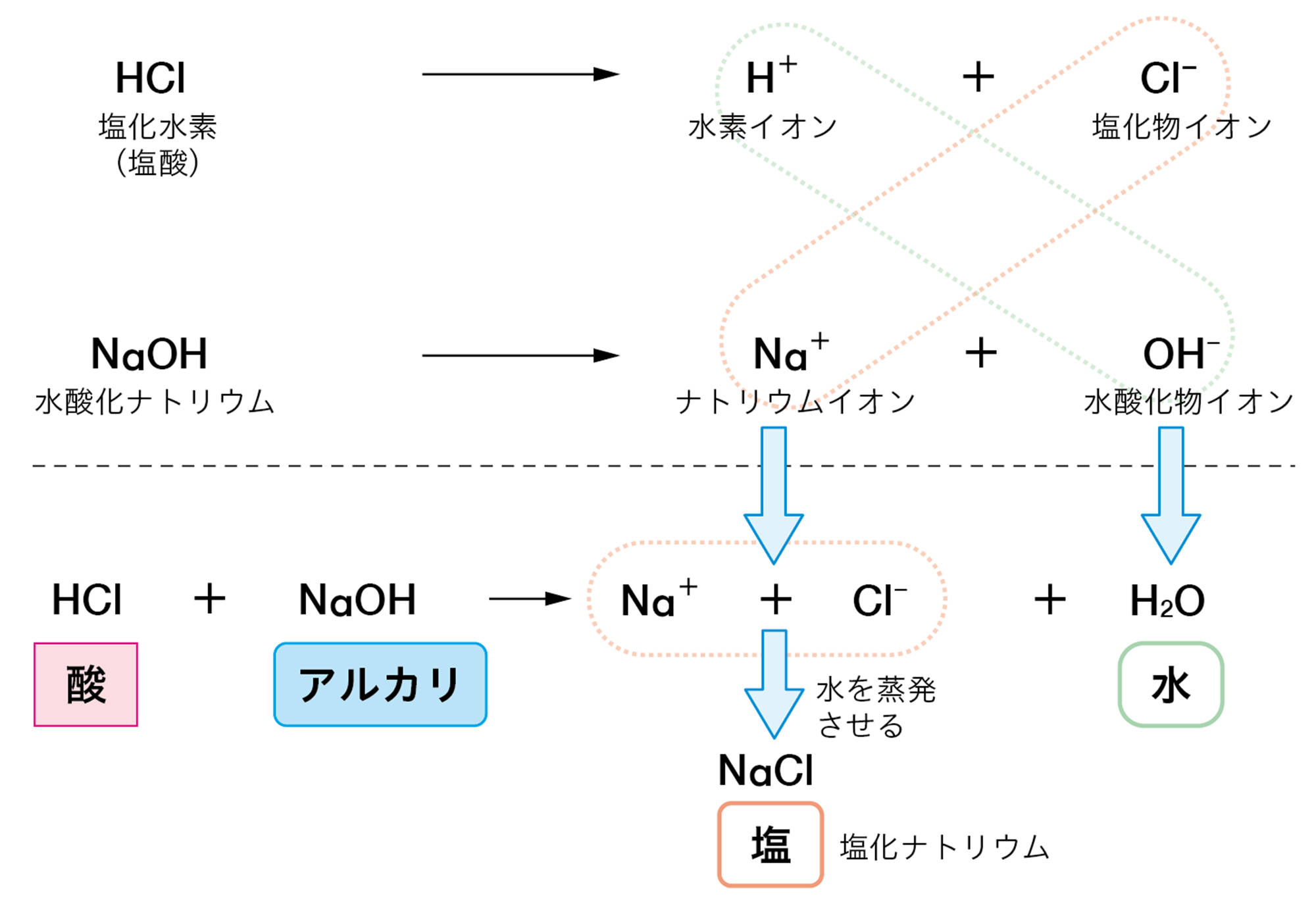
2 塩
塩酸と水酸化ナトリウム水溶液の中和では,反応後の水溶液中にはナトリウムイオンNa⁺と塩化物イオンCl⁻が残っている。この液から水を蒸発させると,Na⁺とCl⁻が結びついて塩化ナトリウムNaClが得られる(図16)。
塩化ナトリウムのように,アルカリの陽イオンと酸の陰イオンとが結びついた化合物を塩という。中和が起こるとき,同時に塩もできている。
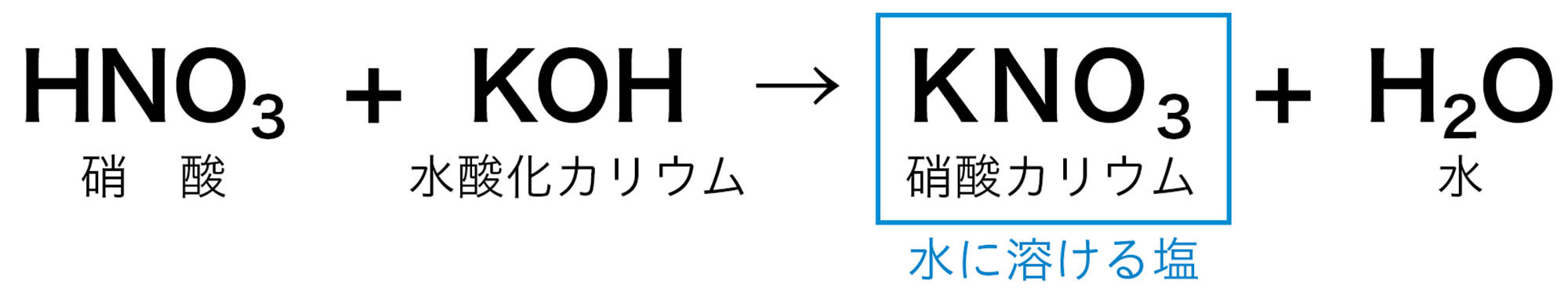
3 さまざまな塩
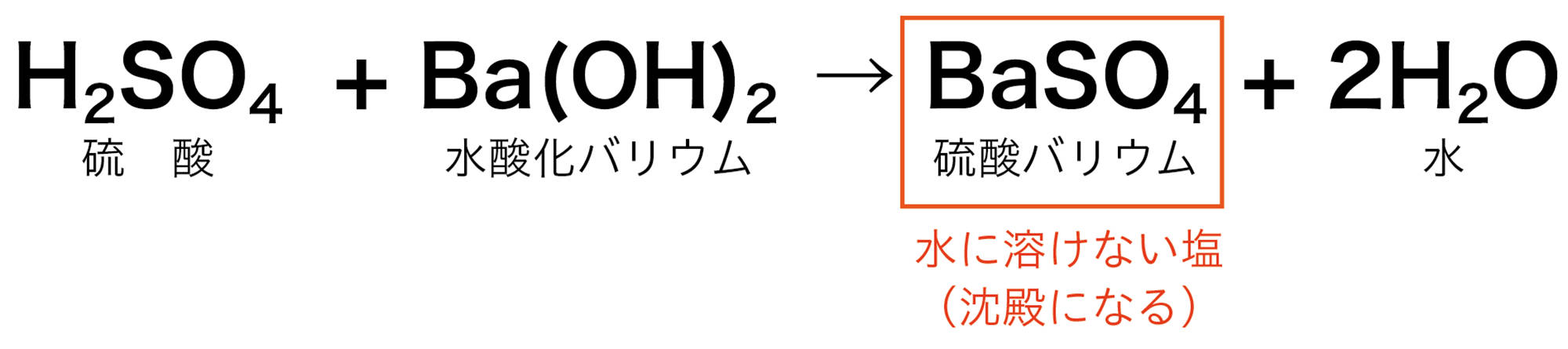
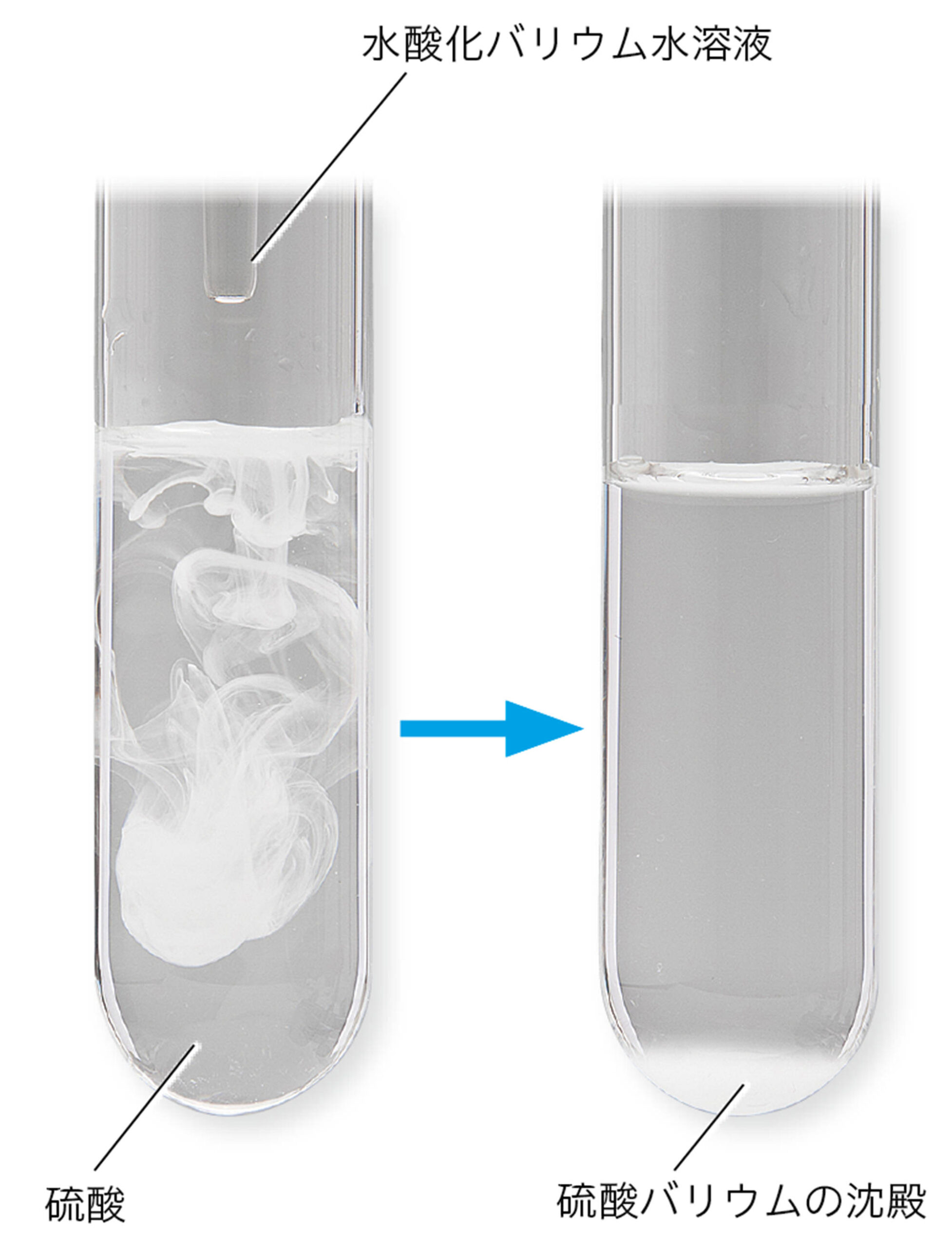
中和が起こるとき水ができることは共通しているが,酸とアルカリの種類によって,できる塩の種類はさまざまである。また,硝酸カリウムなどのように水に溶けやすい塩と,硫酸バリウムのように水に溶けにくく,沈殿ができる塩がある。
※このウェブページは中学校理科3年の学習内容です。<3年p.145>
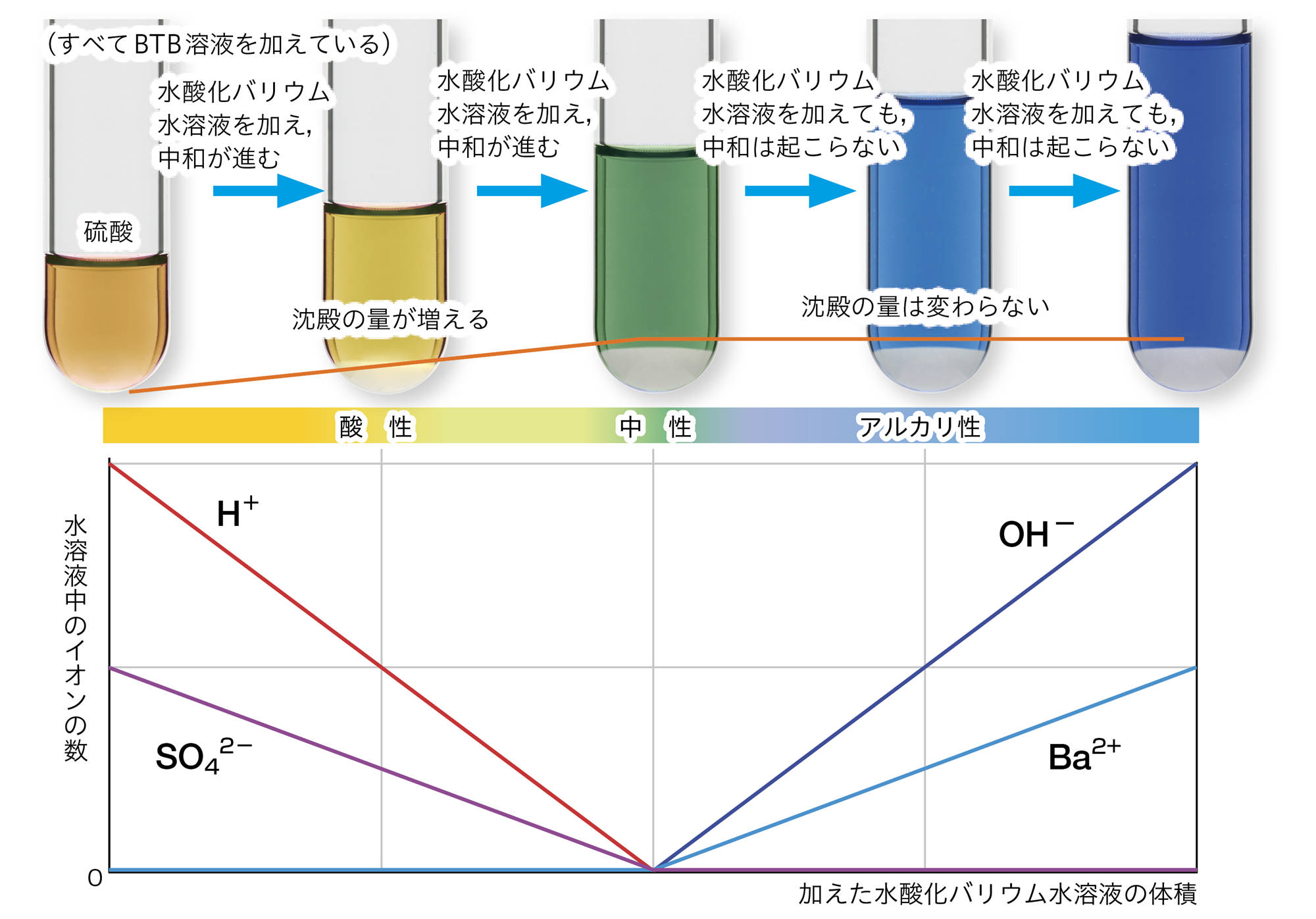
硫酸の化学式はH₂SO₄です。つまり電離により,2個のH⁺が生じるとき,1個のSO₄²⁻が生じます。水酸化バリウムの化学式はBa(OH)₂です。電離により,1個のBa²⁺が生じるとき,2個のOH⁻が生じます。

アルカリ性水溶液を加えていくと,中和が起こってH⁺の数が減少していき,中性を通り過ぎると中和が起こらないので,加えたぶんだけOH⁻の数が増加していきます。中性を通り過ぎると,新たな沈殿も生じなくなります。

ニュース
- 【結晶形成の瞬間、初めて捉えた! 身近な食塩で】 2023年3月1日水に溶けているナトリウムイオンと塩化物イオンが結びつき,塩化ナトリウムが結晶化していく様子を直接撮影することに,東京大学などの研究グループが成功した。 ナトリウムイオンと塩化物イオンは,不安定な結合や、結合が不明瞭な状態を繰り返して成長。四角い結晶核となり安定すると、イオンのペアを加えてさらに成長する。 しかし,やがて蒸発するようにイオンが離れて結晶核が姿を消し、数秒後に再び無秩序からの結晶形成を始めた。この繰り返しを9回撮影できたという。 もと記事リンク