※このウェブページは中学校理科3年の学習内容です。<3年p.144>
2 塩
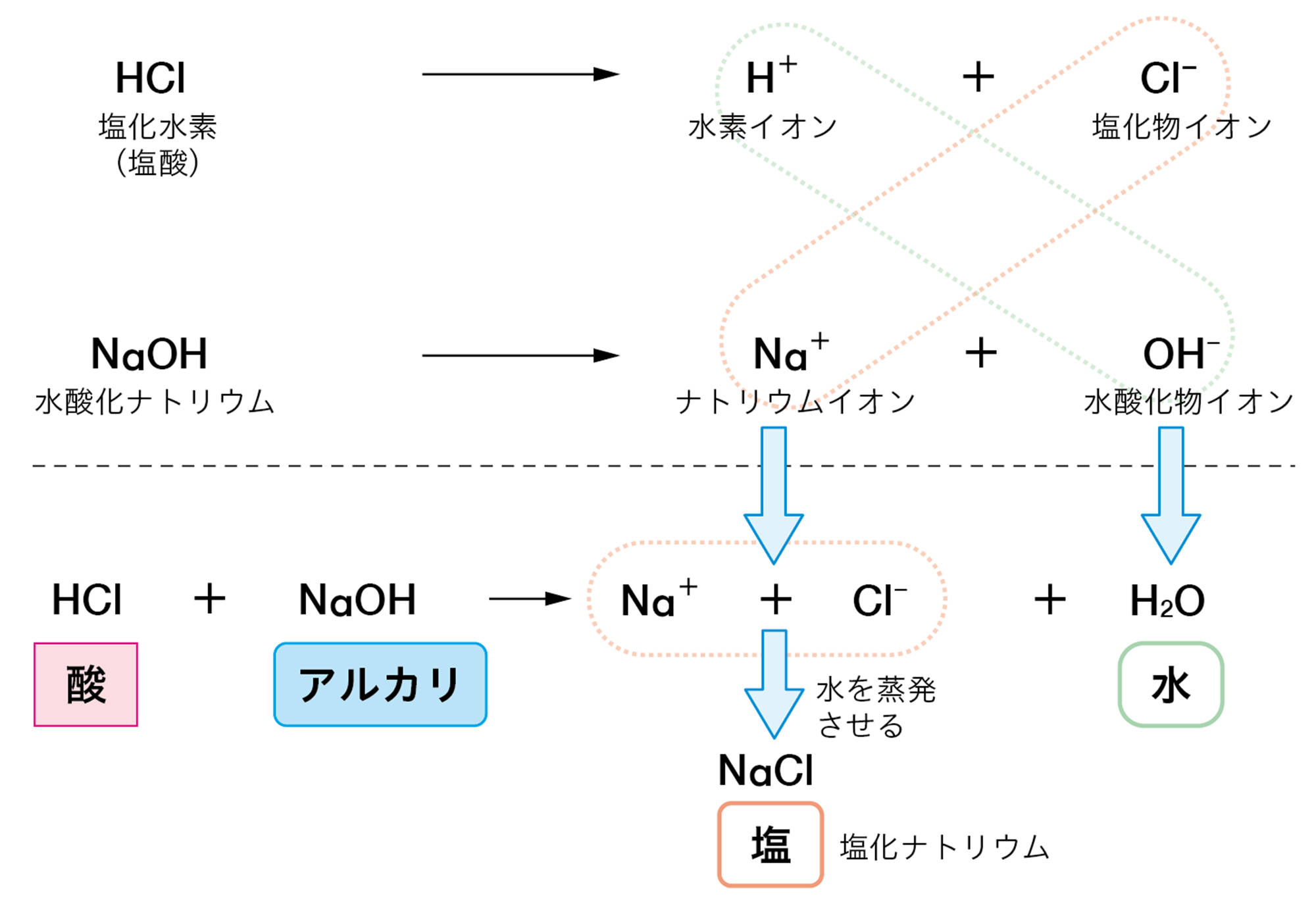
塩酸と水酸化ナトリウム水溶液の中和では,反応後の水溶液中にはナトリウムイオンNa⁺と塩化物イオンCl⁻が残っている。この液から水を蒸発させると,Na⁺とCl⁻が結びついて塩化ナトリウムNaClが得られる(図16)。
塩化ナトリウムのように,アルカリの陽イオンと酸の陰イオンとが結びついた化合物を塩という。中和が起こるとき,同時に塩もできている。
3 さまざまな塩
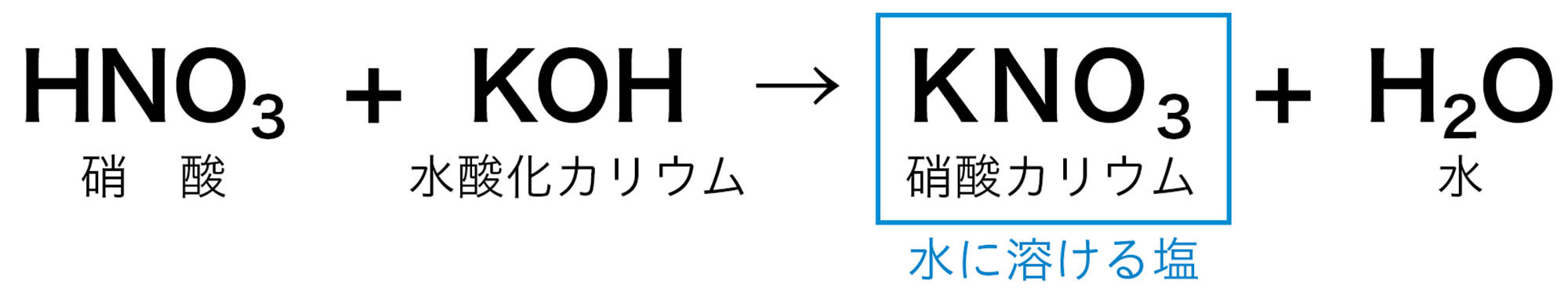
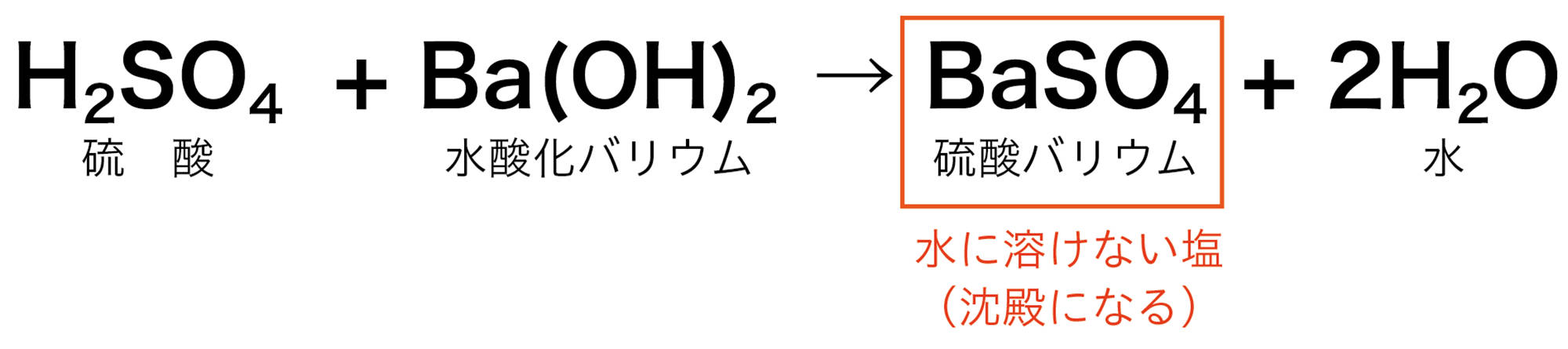
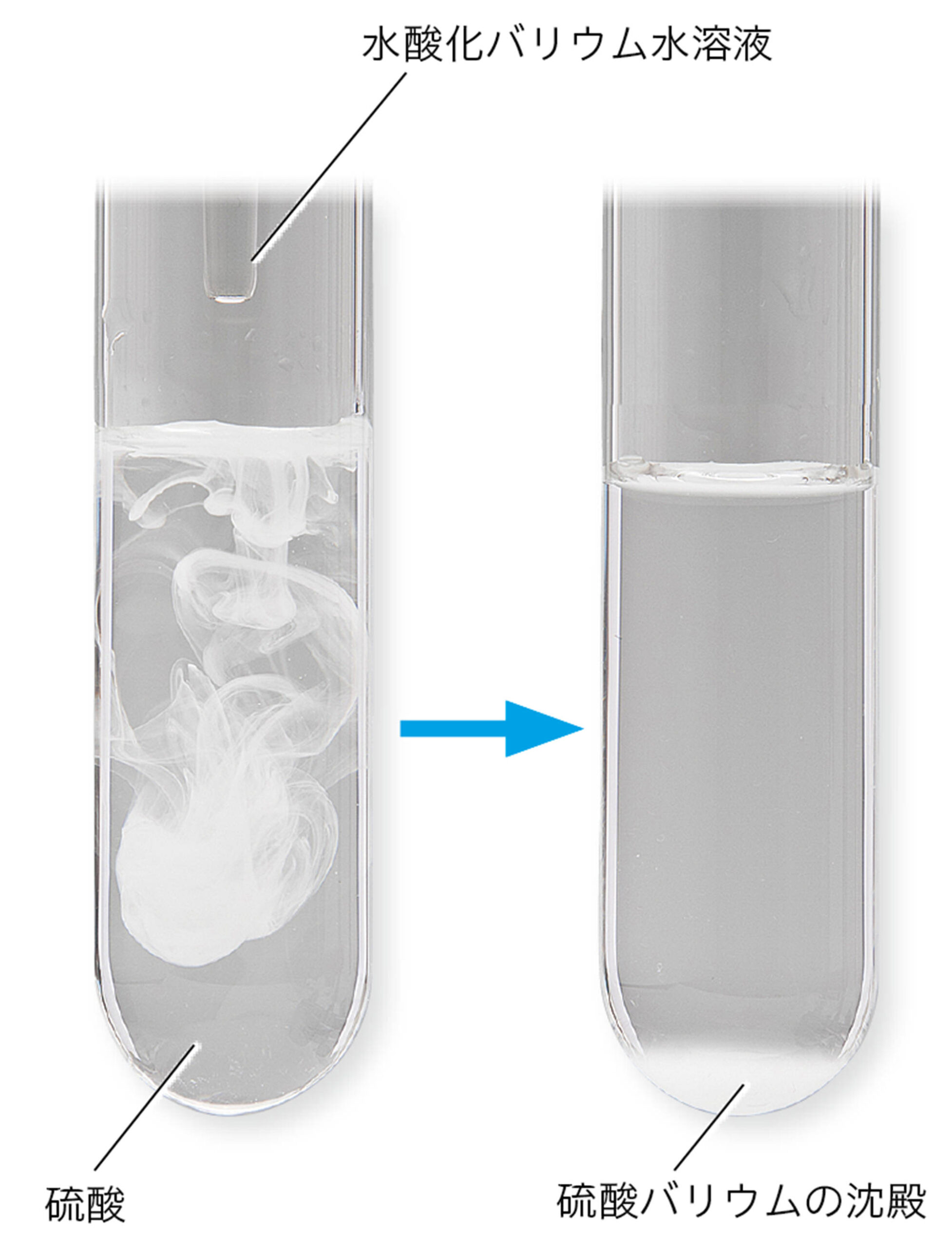
中和が起こるとき水ができることは共通しているが,酸とアルカリの種類によって,できる塩の種類はさまざまである。また,硝酸カリウムなどのように水に溶けやすい塩と,硫酸バリウムのように水に溶けにくく,沈殿ができる塩がある。