※このウェブページは中学校理科3年の学習内容です。<3年p.148>
1|イオンへのなりやすさ
1 酸性の水溶液への金属の溶け方
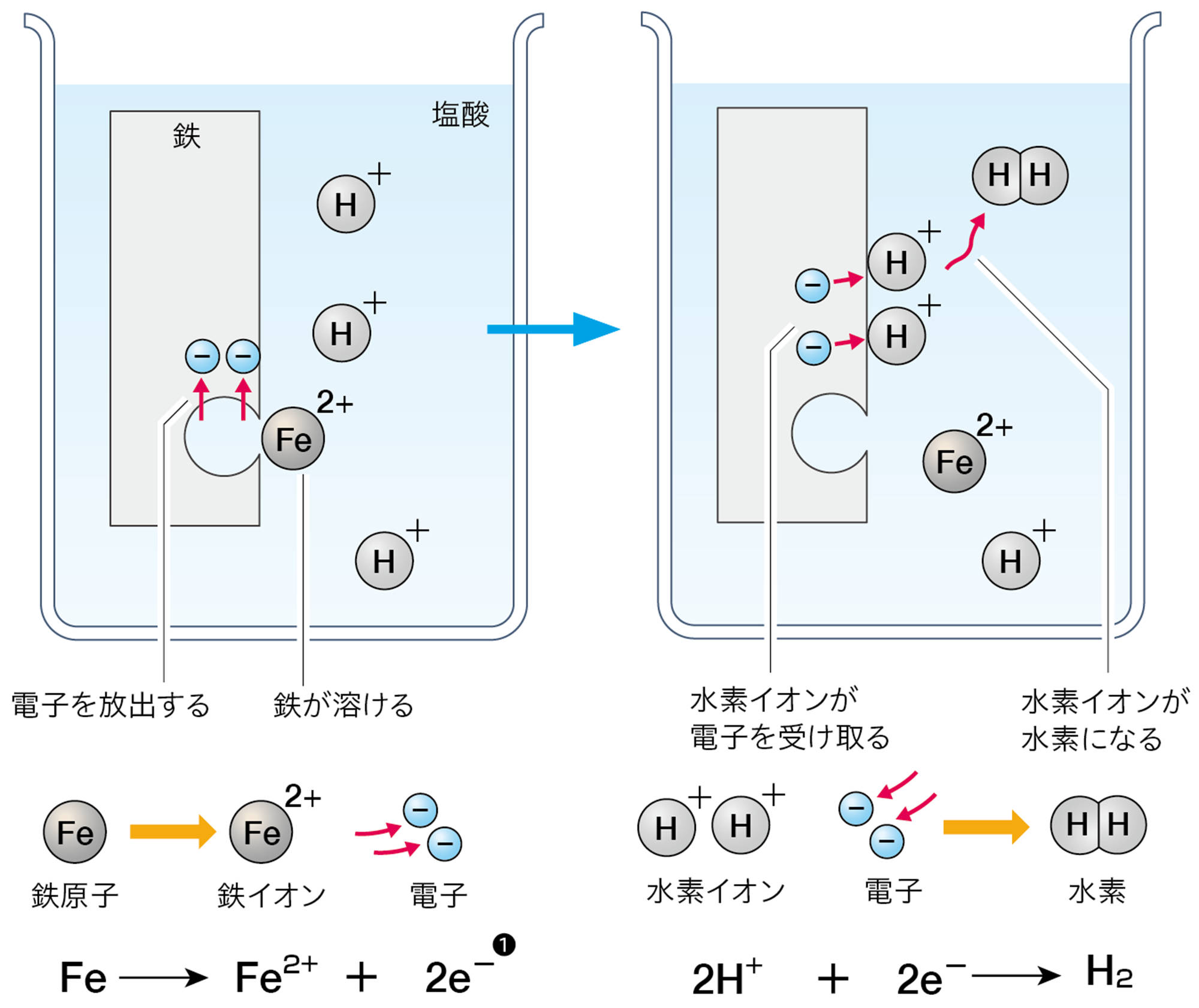
ここでは前の章で学んだ塩酸と金属の反応に注目する。図1のように,塩酸に鉄を入れると,鉄が溶けて水素が発生する。
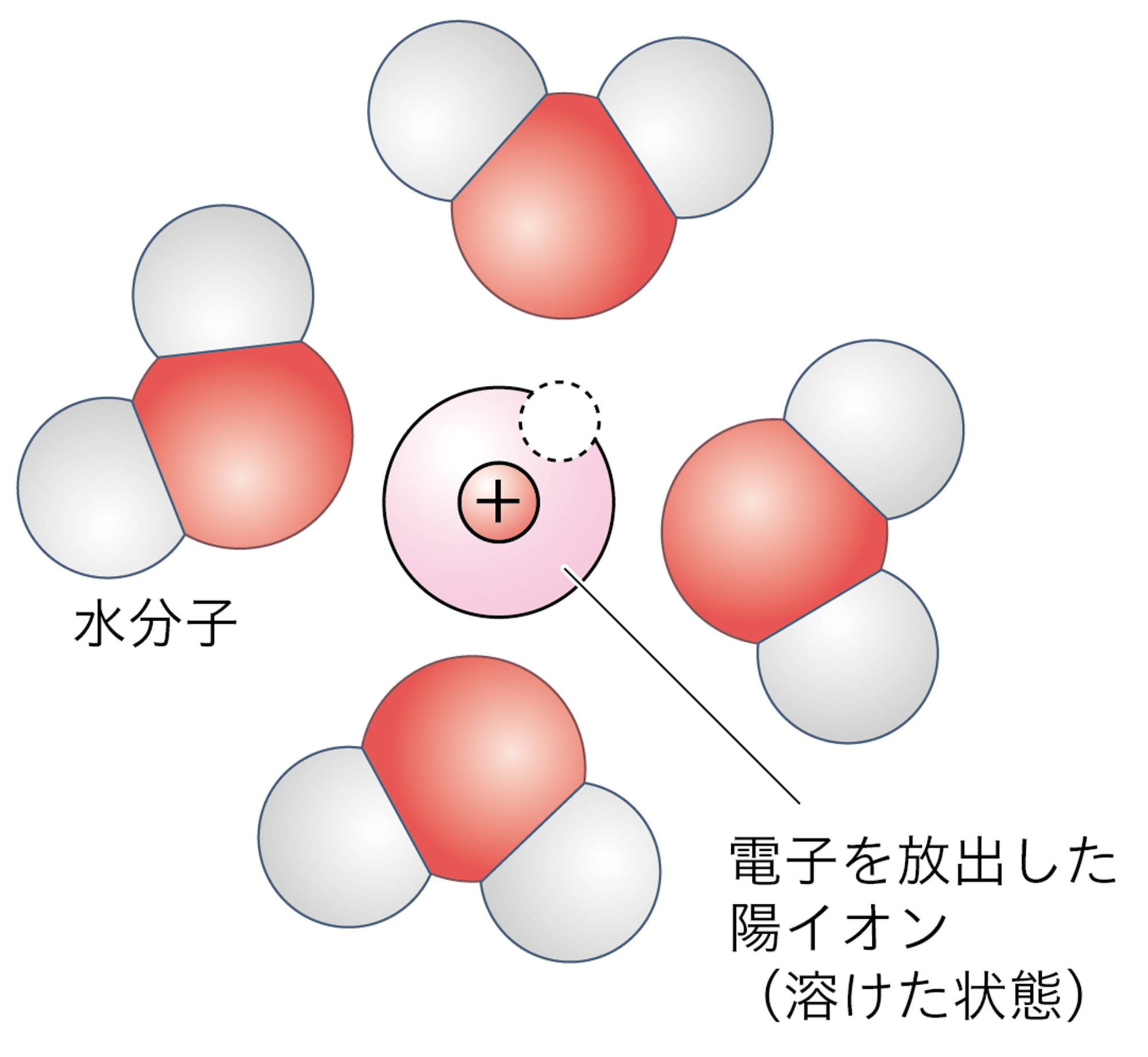
塩酸に鉄が溶けるとき,鉄原子は電子を放出して陽イオンとなり,塩酸の中に広がってゆく。塩酸の水素イオンは,鉄から放出された電子を受け取って水素原子になり,水素原子2個が結びついて水素分子となる(図2)。
塩化物イオンはこの化学変化に関わらないため,省略している。銅に塩酸を加えても,このような化学変化は起こらない。
図2 塩酸と鉄の化学変化をイオンで説明する
❶ 電子は化学式でe−と表す。eは英語の「electron(電子)」の頭文字である。
※このウェブページは中学校理科3年の学習内容です。<3年p.149>
2 金属イオンをふくむ水溶液への金属の溶け方
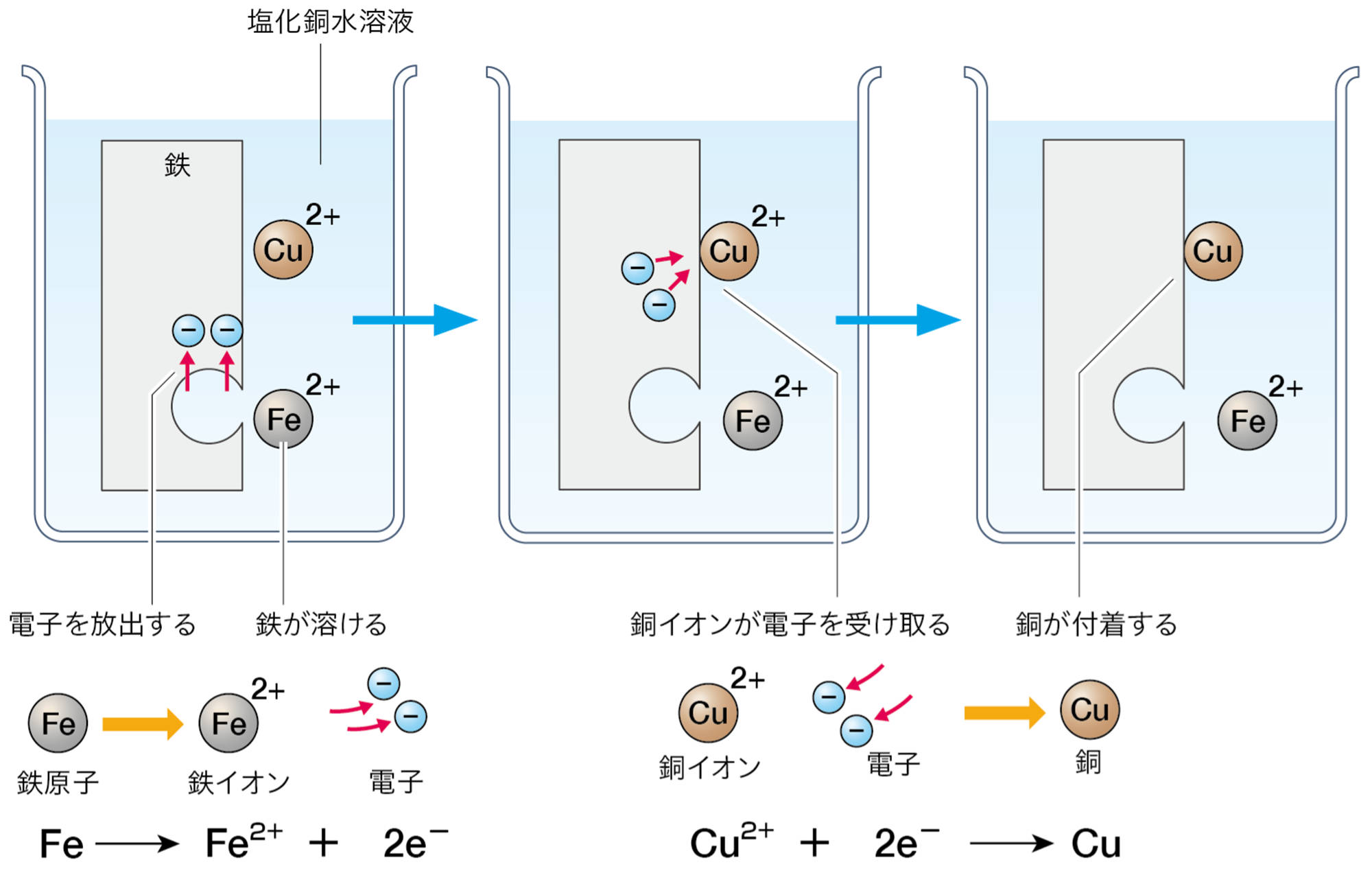
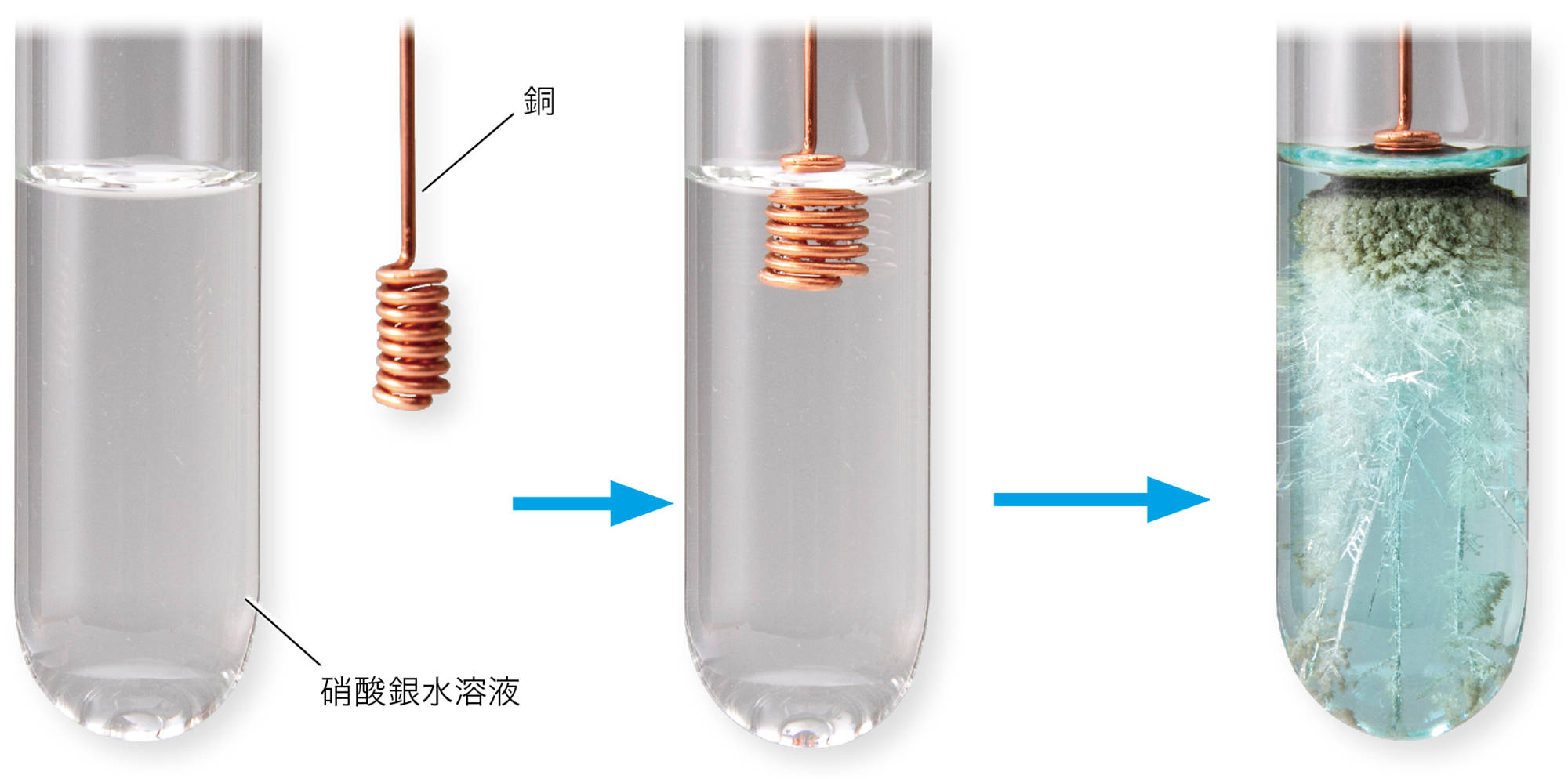
水溶液中の銅イオンを回収する❶ために,図4のような方法が使われる。このとき,鉄に銅が付着することがわかる。
この変化を,イオンの考えでどのように説明できるでしょうか。電子が関わる化学変化でも,化学変化の前後で,原子,イオン,電子の数が変わらないように化学式を考える必要があります。


銅イオンはどのように変化すると銅になるのかな。
図4で,鉄に銅が付着したことから,水溶液中の銅イオンが,銅になったと考えられる。銅イオンが銅になるときは,電子を2つ受け取る必要があり,この電子は,鉄が鉄イオンになったことにより放出されたと考えることができる(図5)。このとき,単体の金属だった鉄は水溶液中に溶け,陽イオンに変わっている。

鉄のくぎに付着した銅は,水溶液中の銅イオンがもとになっているんだね。
この水溶液も,水を蒸発させると塩化鉄が現れます。つまり,鉄が溶けていたことがわかります。

❶ 銅イオンは,それを取りこんだ生物に悪影響があり,環境に排出してよい濃度が決まっている。銅イオンをふくむ水溶液をむやみに流しに捨ててはいけない。
※このウェブページは中学校理科3年の学習内容です。<3年p.150>
3 イオンへのなりやすさ
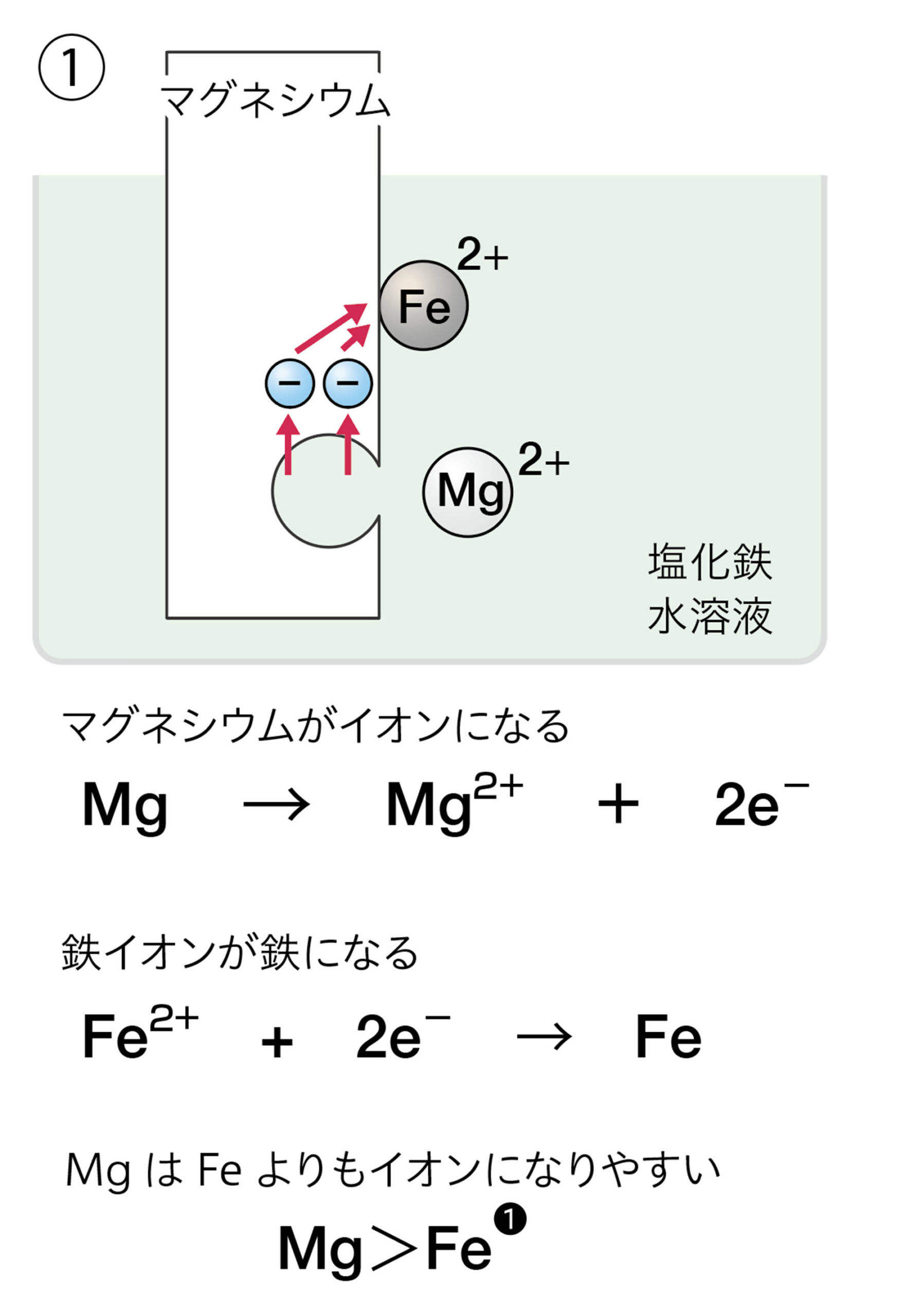
金属の鉄を塩酸に入れると鉄が陽イオンになって溶けた。図6のようにいろいろな金属を塩酸に入れてみると,溶ける金属と溶けない金属があることがわかる。このことから,金属には陽イオンになりやすいものと,なりにくいものがあるといえる❶。
金属の種類によって,酸に溶けるかどうかが異なるね。

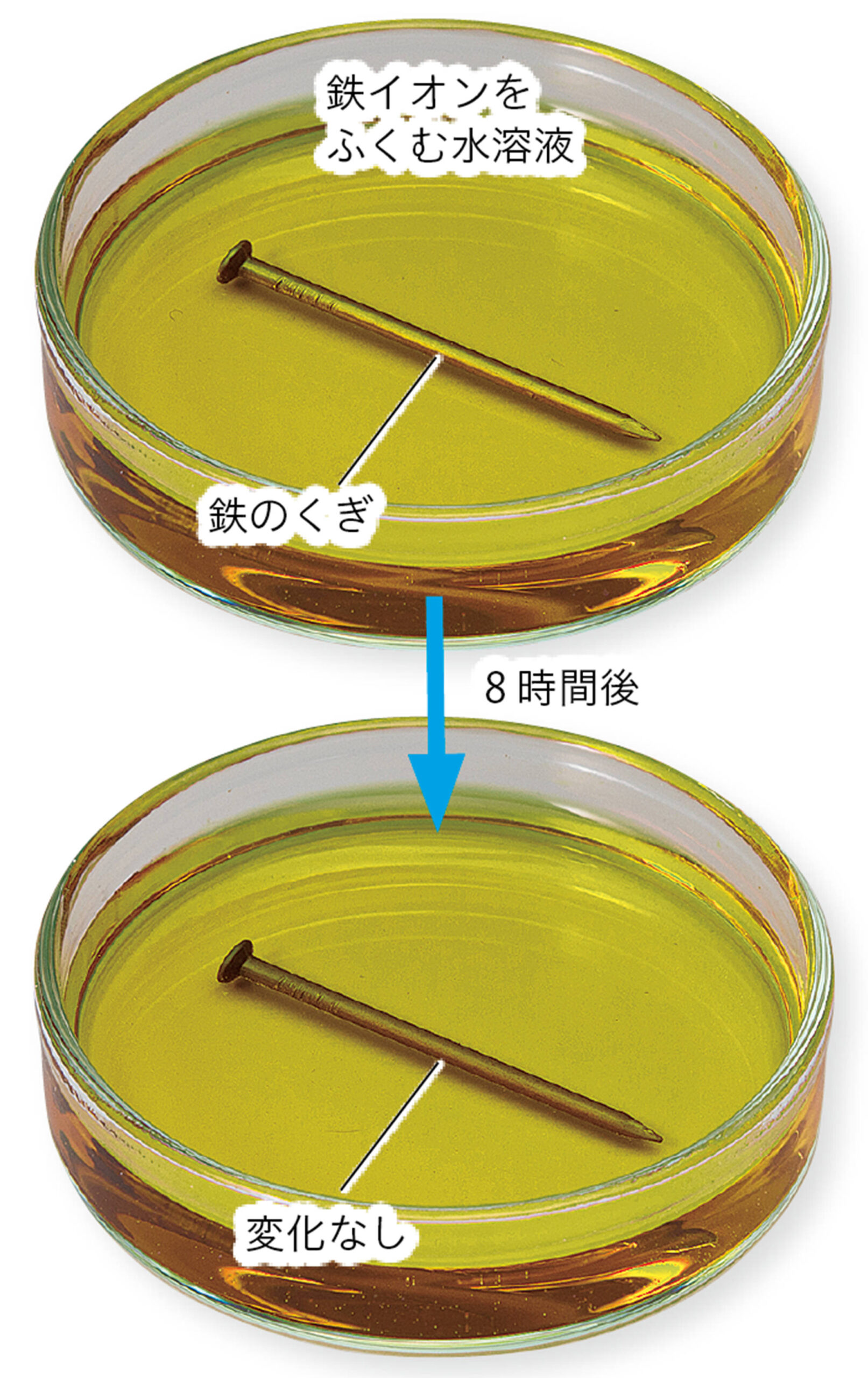
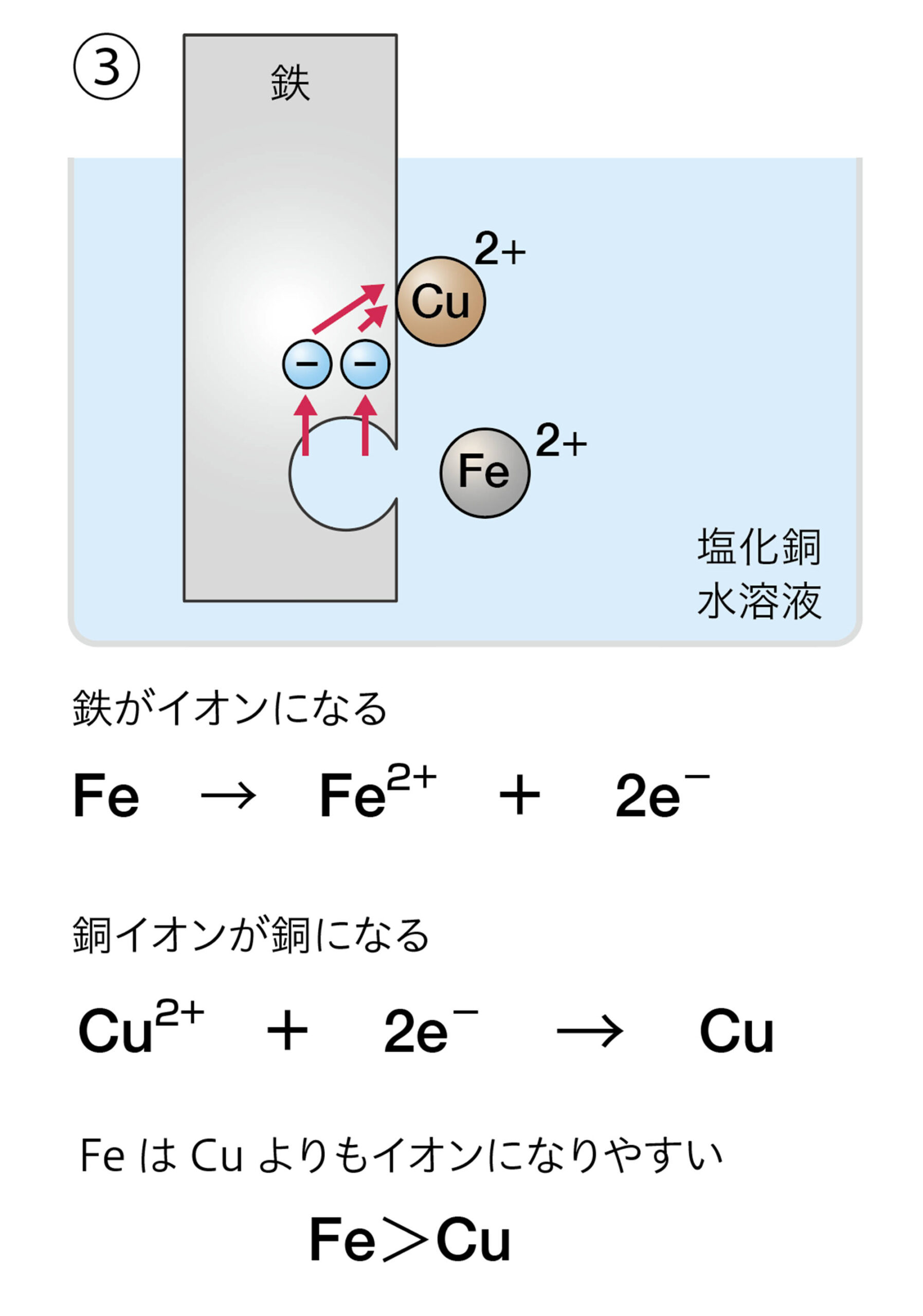
また,銅イオンをふくむ塩化銅の水溶液に金属の鉄を入れると鉄が陽イオンになって溶けた。しかし,逆に,鉄イオンをふくむ塩化鉄水溶液に,金属の銅を入れても溶けない(図7)。このことから鉄は銅よりも陽イオンになりやすいことがわかる❷。
図7 金属イオンをふくむ水溶液の化学変化
❶ 水溶液中のイオンが金属(原子)になって付着したことに着目した場合は,銅は鉄よりもイオンが原子にもどりやすい(イオンになりにくい)といえる。
❷ 金属Aのイオンをふくむ水溶液に金属Bを入れたとき,金属Bに金属Aが付着する場合,AはBよりイオンになりにくく金属にもどりやすいといえる。
※このウェブページは中学校理科3年の学習内容です。<3年p.151>
金属の種類による陽イオンへのなりやすさのちがいを,くわしく理解しようとしたとき,どのように科学的に探究することができるだろうか。
探究5 イオンへのなりやすさ

銅は銅イオンにならないのかな?鉄はいつでも鉄イオンになるのかな?
水溶液中の金属イオンが金属になる条件があるのかな。


塩化鉄水溶液に鉄くぎを入れても,鉄イオンが鉄になるわけではないね。
銅が銅イオンになることはあります。銀イオンがふくまれる水溶液に銅を入れると,銅がイオンになり,水溶液に溶けます。


金属の組み合わせが,関係していると予想できますね。
「イオンへのなりやすさ」は,金属の種類によってどのように変わるだろうか。

金属により,イオンへのなりやすさがちがうとしたら,順番があるのかな。
順番ではなく,じゃんけんのような関係があるのかも。


金属とその金属イオンが溶けている水溶液ではどうなるかな。

ここでは,あつかう金属は,Mg,Fe,Cuにします。
塩化銅水溶液は,Cu²⁺が溶けている水溶液。他に,Mg²⁺,Fe²⁺が溶けている水溶液が必要だね。


ある金属と,それとは別の種類の金属イオンが溶けている水溶液について,「どちらの金属がイオンになるか」を確かめるためには,試合などの「総当たり戦」の方法を参考にして,組み合わせにもれがないようにしよう。
※このウェブページは中学校理科3年の学習内容です。<3年p.152>
準備
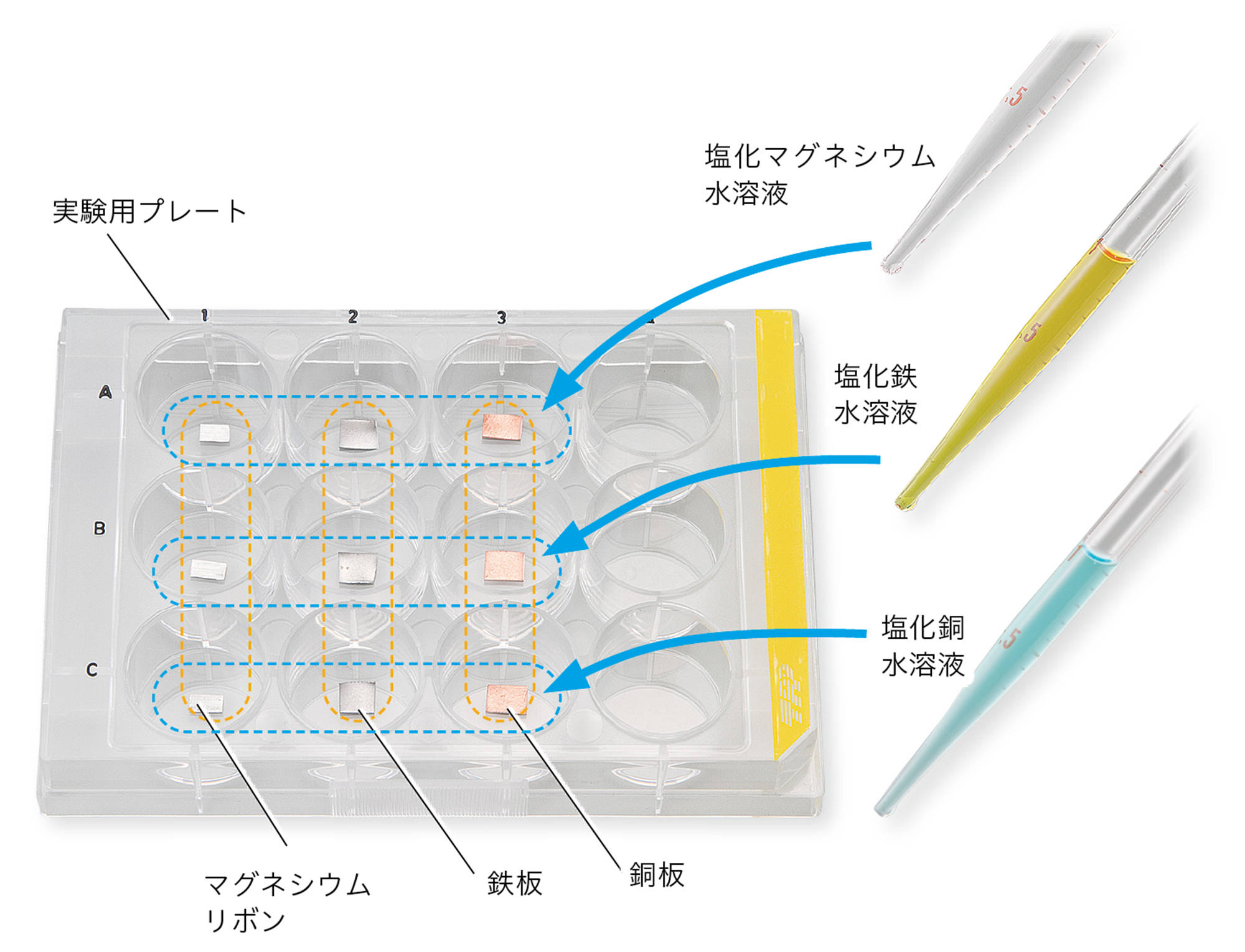
塩化マグネシウム水溶液(10%),塩化鉄水溶液(10%),塩化銅水溶液(10%),マグネシウムリボン,鉄板,銅板,こまごめピペット(3),実験用プレート,ピンセット,磁石,薬さじ(プラスチック製),キッチンタオル,保護めがね
A イオンへのなりやすさを比較する
① 3種類の金属を1cmほどに切り,実験用プレートのそれぞれのしきりに入れる。
② 塩化マグネシウム水溶液,塩化鉄水溶液,塩化銅水溶液それぞれをこまごめピペットでとり,3種類の金属に水溶液を数滴たらして変化を観察する。
実験Aで金属板に現れた物質をつきとめるには,実験Bの方法があります。

B 現れた金属を確かめる
※このウェブページは中学校理科3年の学習内容です。<3年p.153>
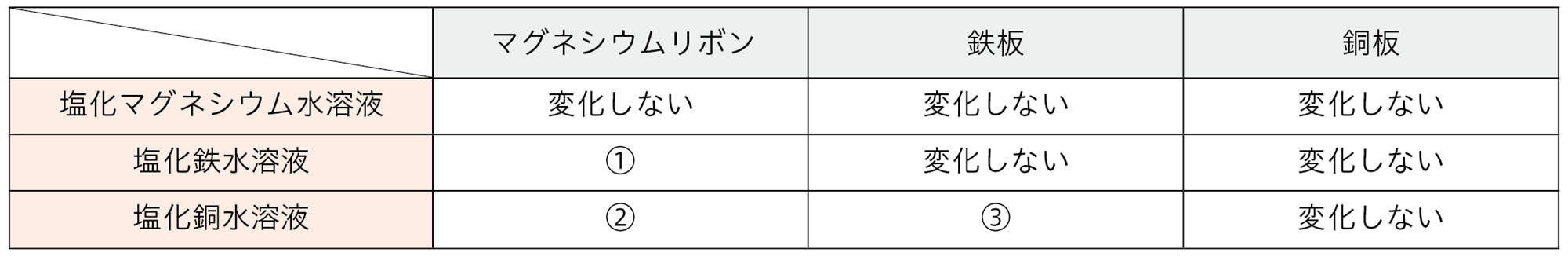
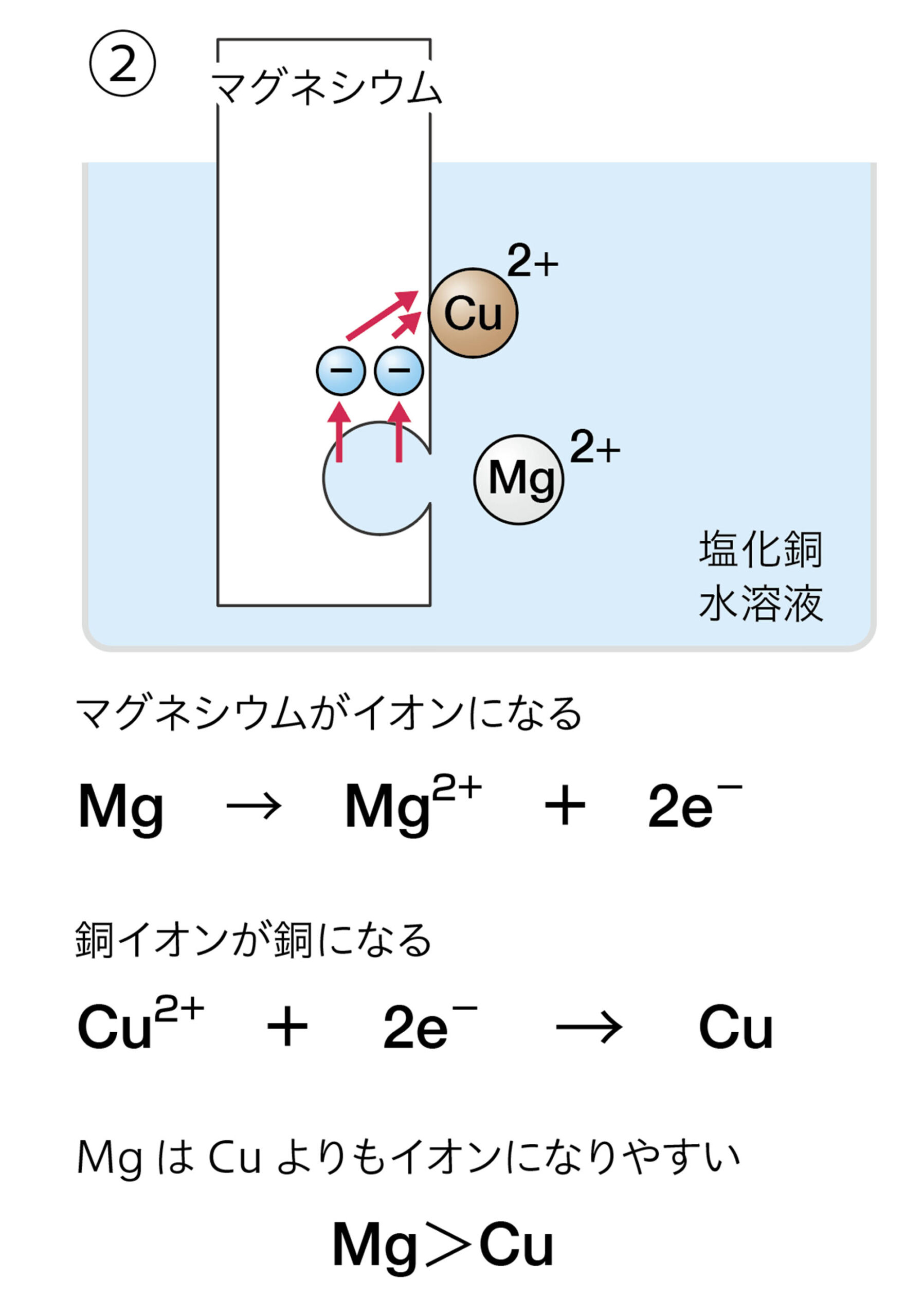
探究5を行うと,鉄は銅に比べ陽イオンになりやすく,マグネシウムは銅や鉄に比べ陽イオンになりやすいことがわかる。このような実験から,金属は,その種類によってイオンへのなりやすさに差があることがわかる(図10)。
イオンになりやすい金属が陽イオンになって水溶液中に溶けるとき,電子を放出する。水溶液中のイオンになりにくい金属イオンは,電子を受け取って金属原子になり,金属板に付着する。
図9 金属がイオンになるしくみ
ここでの化学変化に関わらないCl⁻は,省略している。

金属のイオンへのなりやすさは,一列にならべられるんだね。
❶ ここでは,イオンになりやすいか,なりにくいかは,不等号>で表している。また,一般にイオンになりやすい金属ほど左に表す。