gkt-horizontal-line
※このウェブページは中学校理科3年の学習内容です。<3年p.148>
1|イオンへのなりやすさ
1 酸性の水溶液への金属の溶け方
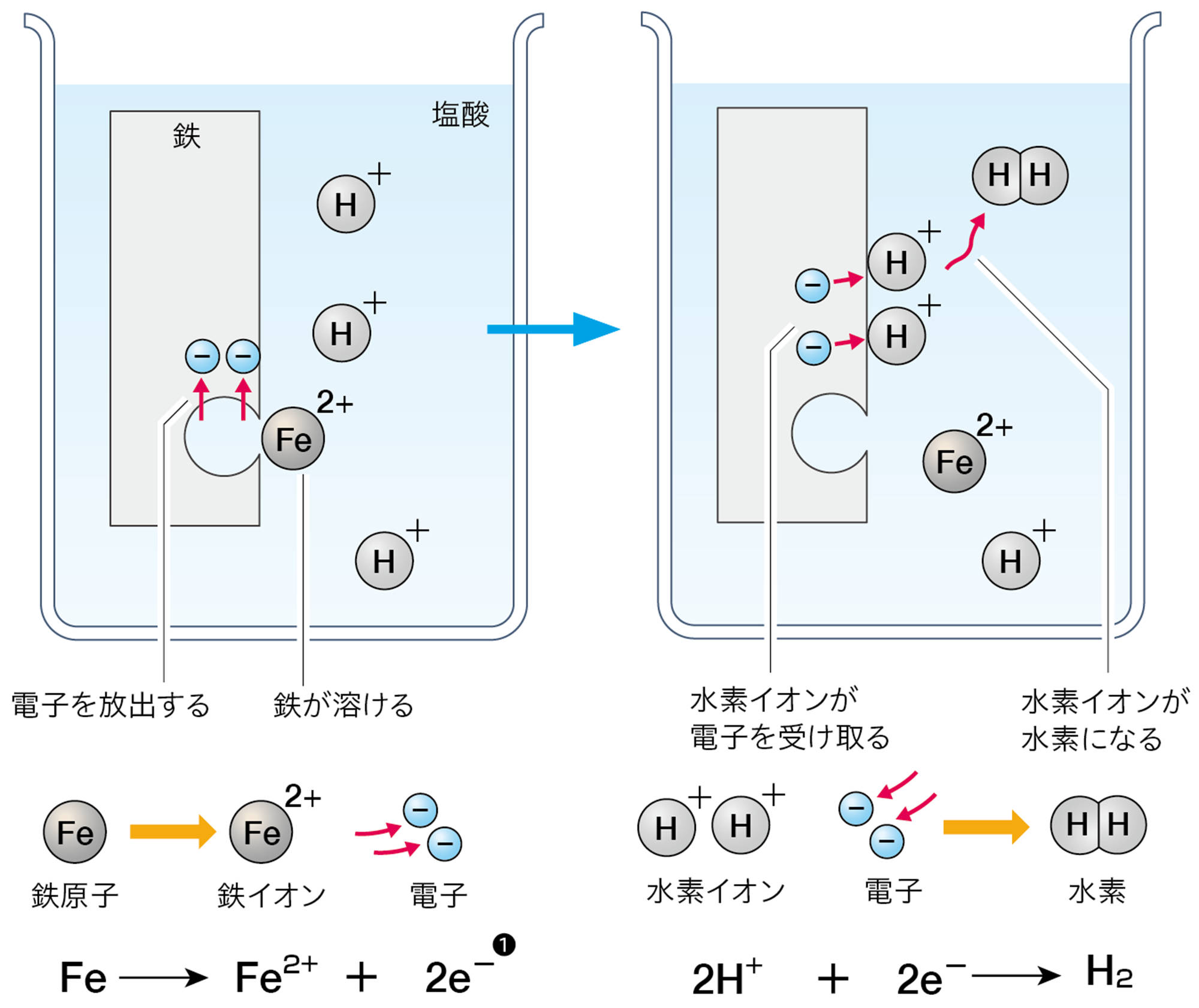
ここでは前の章で学んだ塩酸と金属の反応に注目する。図1のように,塩酸に鉄を入れると,鉄が溶けて水素が発生する。
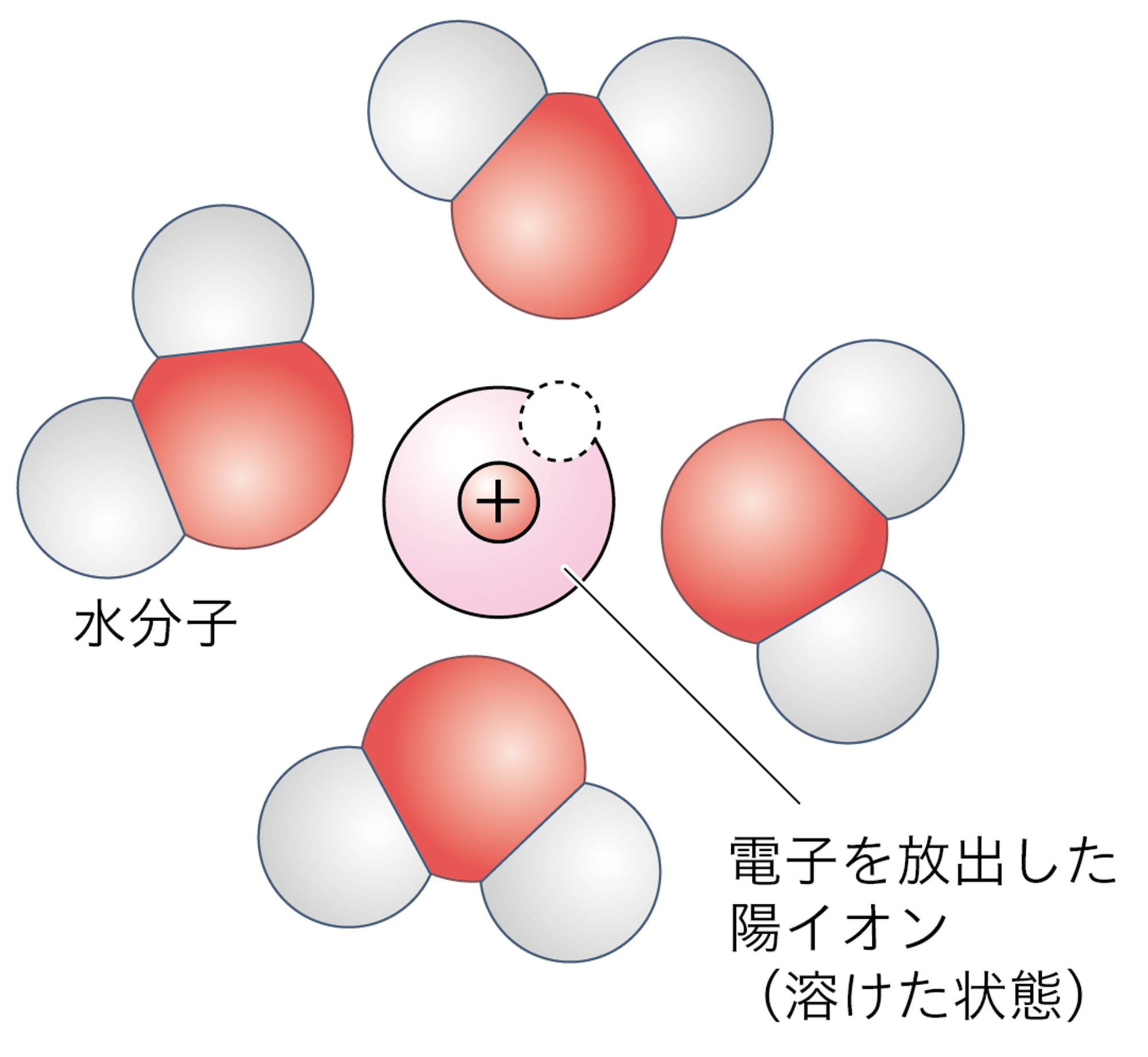
塩酸に鉄が溶けるとき,鉄原子は電子を放出して陽イオンとなり,塩酸の中に広がってゆく。塩酸の水素イオンは,鉄から放出された電子を受け取って水素原子になり,水素原子2個が結びついて水素分子となる(図2)。
塩化物イオンはこの化学変化に関わらないため,省略している。銅に塩酸を加えても,このような化学変化は起こらない。
図2 塩酸と鉄の化学変化をイオンで説明する
❶ 電子は化学式でe−と表す。eは英語の「electron(電子)」の頭文字である。