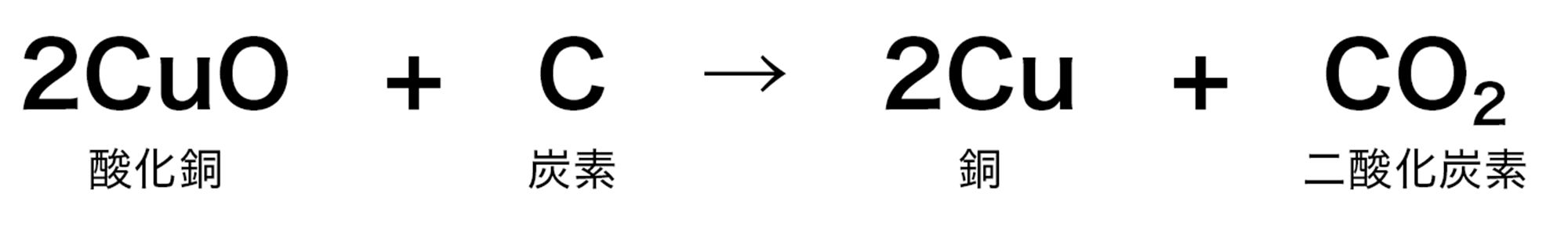※このウェブページは中学校理科2年の学習内容です。<2年p.54>
1|酸素が関わる化学変化
1 自然界の酸化物
私たちの身のまわりには,鉄や銅などの金属製品が多くある。これらの金属は自然界にある鉱物から取り出している。金属の多くは酸化物の状態で鉱物中に存在しており,たとえば鉄鉱石には鉄が酸化鉄などとして,銅鉱石には銅が酸化銅などとしてふくまれている(図1)。
金属は酸化物として存在するとき,金属単体としての有用な性質がない。私たちは化学変化を応用して,このような酸化物から単体の金属を取り出し,利用している。
2 金属の製錬
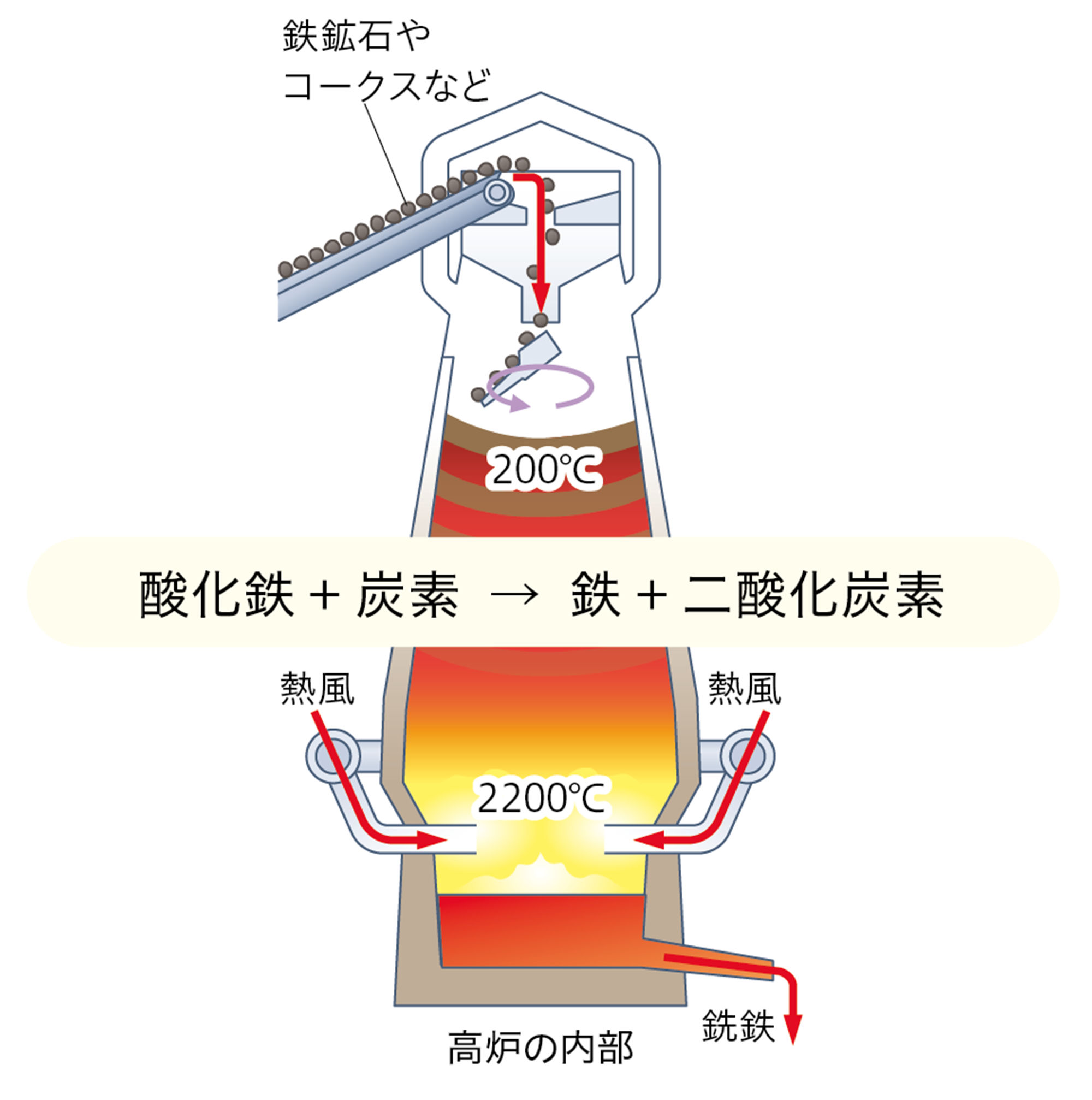
酸化鉄や酸化銅から単体の鉄や銅を得るには,酸化物から酸素を取り除く必要がある。鉱石にふくまれる金属の酸化物から酸素を取り除くなどして,金属の単体を得ることを製錬という。たとえば製鉄所では,鉄鉱石をコークス(炭素)といっしょに加熱して,単体の鉄を得ている(図2)。
鉄鉱石にふくまれる酸化鉄は,鉄と酸素が強く結びついている。鉄より酸素と結びつきやすいコークス(炭素)といっしょに加熱すると,酸化鉄から酸素が離れて炭素と結びつき,鉄と二酸化炭素ができる。
図2 鉄の製錬
※このウェブページは中学校理科2年の学習内容です。<2年p.55>
人の歴史上で,金属の製錬がはじまったのは紀元前だといわれている。当時は原子という考えも化学変化という考えも,もちろん存在せず,「理由はわからないが,試行錯誤の結果そうなる」という経験をもとに金属の製錬が発達してきた。
では,現在の私たちは,この製錬の原理をどのように科学的に探究できるだろうか。
探究7 銅を取り出す
酸化銅から銅を取り出すにはどうすればよいか。化学反応式から仮説を立て,できる物質を実験で確かめる。

鉄鉱石の製錬と同じように考えられないかな。
炭素Cを加えて加熱したら,どうなるだろう?


化学変化でどのような物質が現れるかな?化学反応式を予想してみよう。

発生する物質を予想して,その物質を確かめる方法を考えよう。
銅であることを確かめる方法はなんだっけ?


Cのほかにも,酸素と結びつく物質があるのではないかな。計画してみよう。
※このウェブページは中学校理科2年の学習内容です。<2年p.56>
準備
酸化銅の粉末,炭素粉末,石灰水,乳鉢,乳棒,試験管(2),試験管立て,一穴ゴムせん,ゴム管,ガラス管,目玉クリップ,スタンド,加熱器具,薬さじ(金属製),電子てんびん,薬包紙,ろ紙,軍手,保護めがね
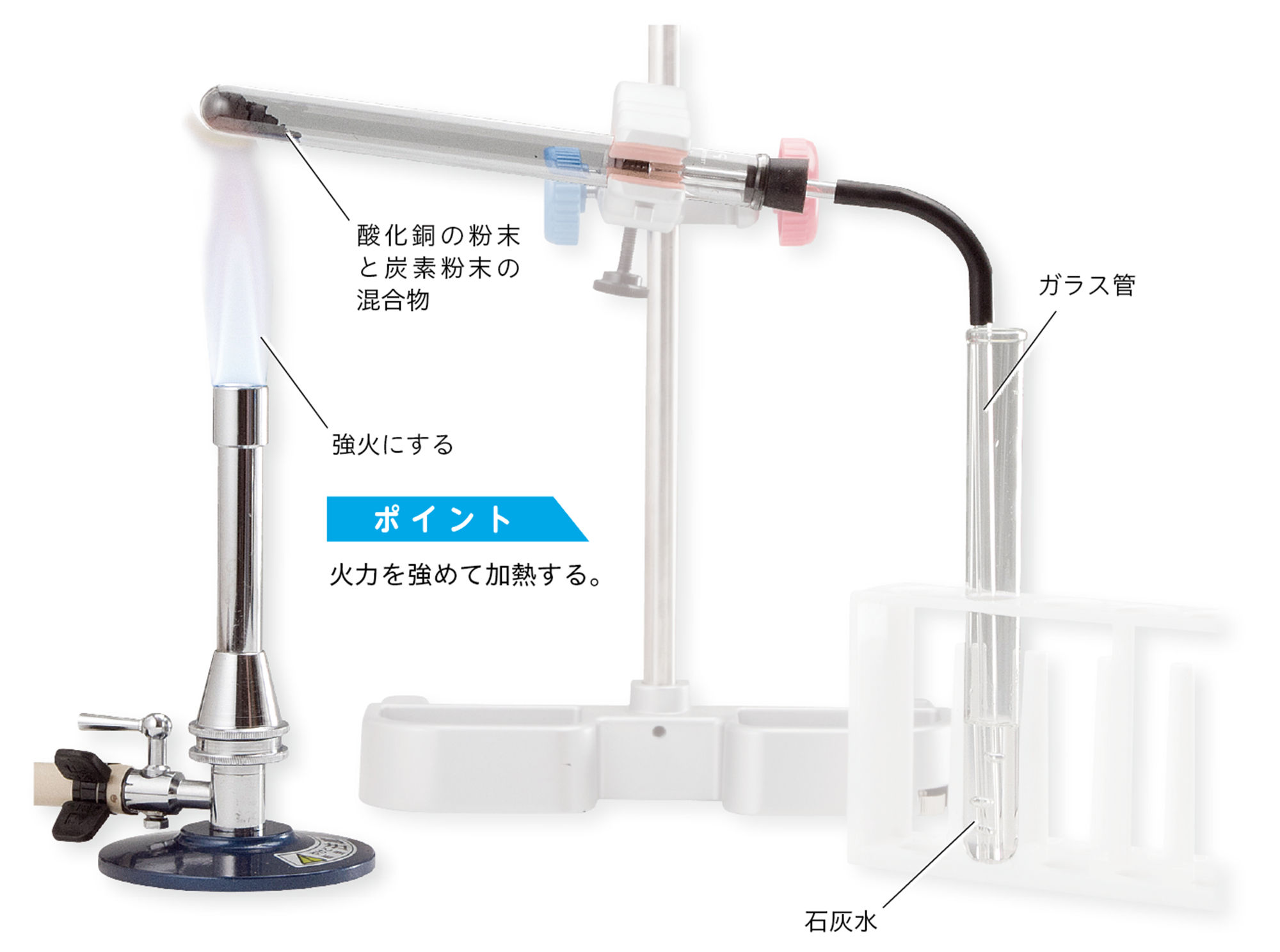
1.酸化銅の粉末と炭素粉末を混ぜる
酸化銅の粉末1.3gと炭素粉末0.1gをよくすり混ぜる。
2.加熱する
1.の混合物を試験管に入れて,図のような装置で加熱し,変化のようすを観察する。
① 気体が発生しなくなったら,ガラス管を石灰水からぬく。
② 火を消す。
注意!! 石灰水に入れたガラス管は加熱をやめる前に石灰水から出しておく。ゴム管が熱くなっているので軍手をして持つ。

化学反応式からは水の発生は予想できません。予想しない現象が起こることも考え,試験管の口を下げています。
3.加熱後の物質を調べる
試験管を冷ましてから,試験管の中の物質を取り出して観察する。また,薬さじの裏で強くこする。
※このウェブページは中学校理科2年の学習内容です。<2年p.242>
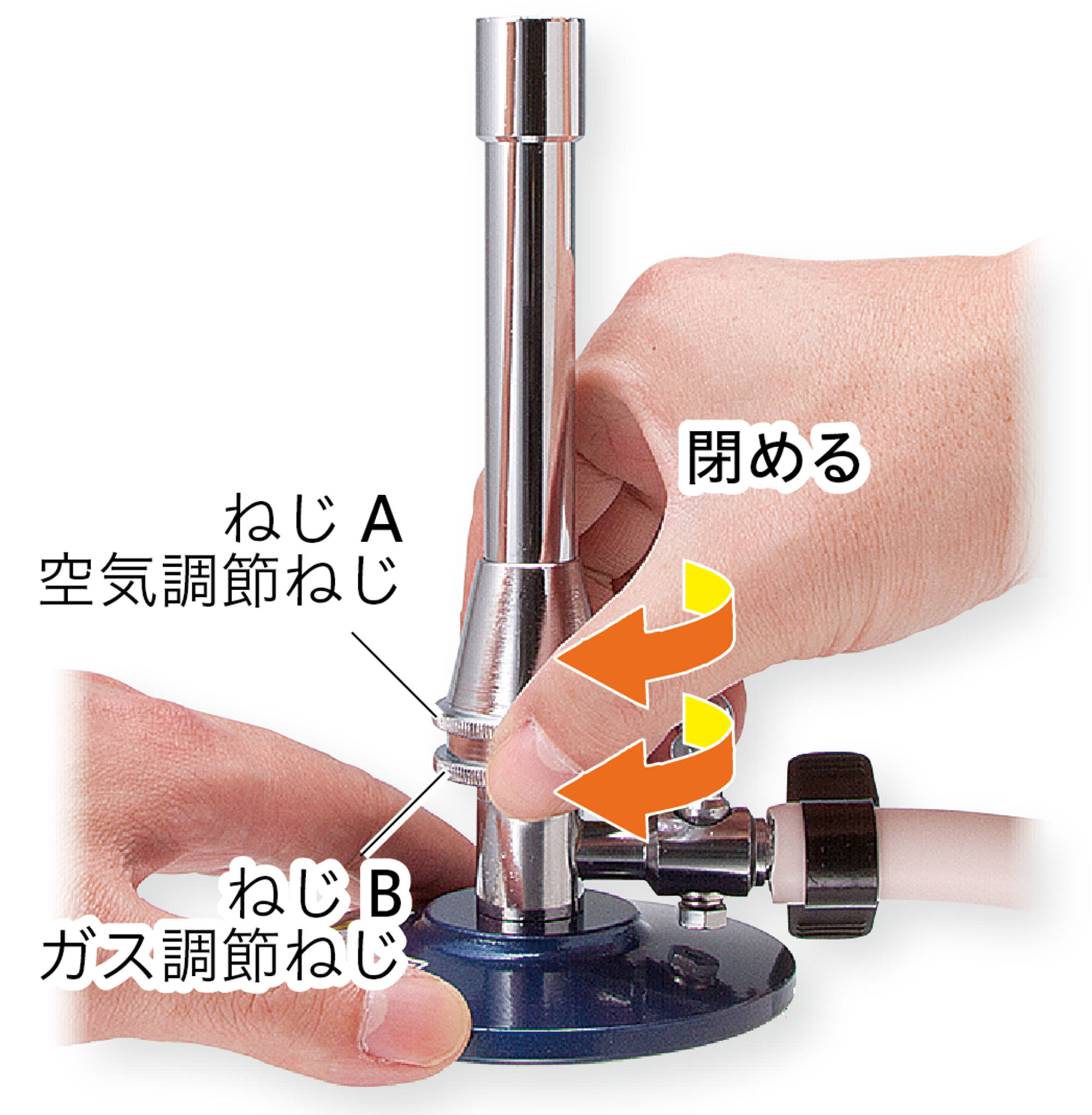
基本操作 ガスバーナーの使い方
注意!! 火を消した直後は,ガスバーナーの口の付近は熱くなっているので,さわらないよう注意する。
※このウェブページは中学校理科2年の学習内容です。<2年p.57>
ポイント
- 発生した気体には,どのような性質があったか。
- 加熱後,試験管にどのような物質が残ったか。
ポイント
- 石灰水の変化から考えて,発生した気体は何か。
- 薬さじでこすって現れた色などから考えて,試験管に残った物質は何か。
- この探究で観察した化学変化は,化学反応式でどのように表されるか。
※このウェブページは中学校理科2年の学習内容です。<2年p.58>
探究7 結果から考察する
図5 探究7の結果例
- 発生した気体を石灰水に通すと,石灰水が白くにごった。
- 試験管に残った物質は赤色で,薬さじで強くこすると,金属光沢が見られた。
- 発生した気体を石灰水に通すと,石灰水が白くにごった。
- 試験管に残った物質は赤色で,薬さじで強くこすると,金属光こう沢たくが見られた。・ 実験で発生した気体は,石灰水を白くにごらせたことから二酸化炭素であることがわかる。
- 試験管に残った物質は,赤色で金属光沢があることから銅であることがわかる。
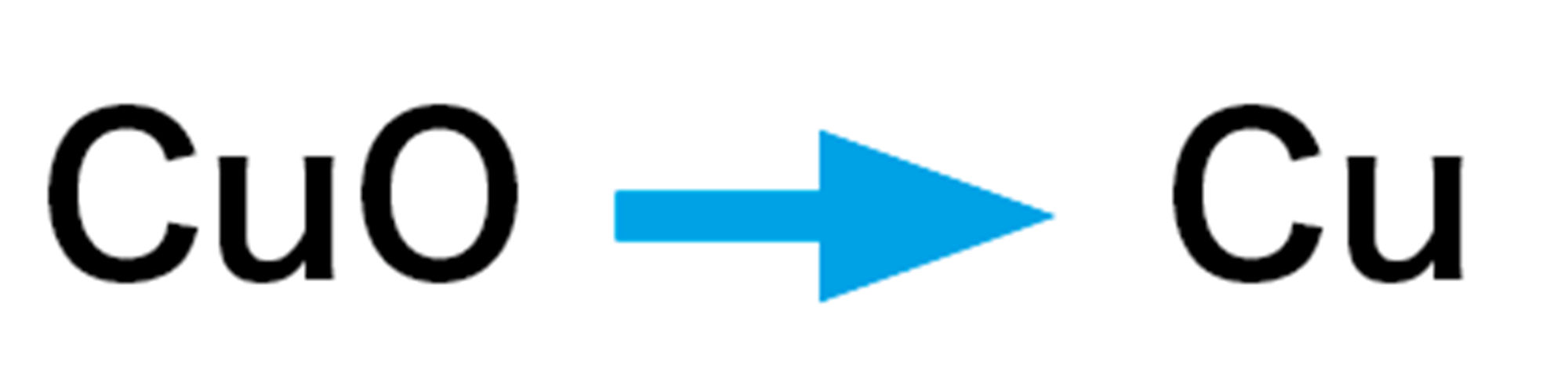
- この化学変化を化学反応式で表すと,次のようになる。

火をとめたあと,ゴム管をクリップでとめたのはなぜかな?
還元されてできた銅が,また酸化されないようにするためです。加熱した直後は,還元されてできた銅が高温で,空気とともに酸素が入ってくると結びつきやすい状態になっています。

※このウェブページは中学校理科2年の学習内容です。<2年p.59>
3 還元
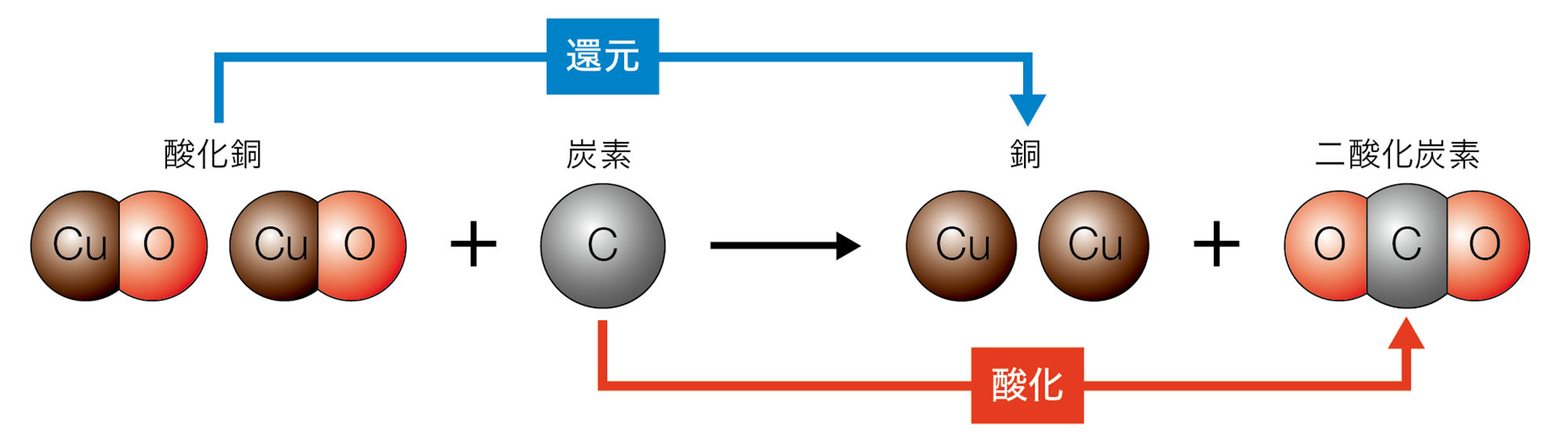
探究7のように,酸化物から酸素を取り除く化学変化を【還元】という。還元は,酸化と反対の化学変化である。酸化銅が還元されるとき,炭素は酸化銅から取り除いた酸素によって酸化されている。このように,還元が起こるときは,同時に酸化も起こる(図6)。
還元が起こるのは,酸素と結びつきやすい物質(探究7の場合は炭素)が,酸化銅の酸素と結びついて酸化物(二酸化炭素)となり,もとの酸化物(酸化銅)が単体(銅)として残るからである。
この実験から,炭素と銅を比べると炭素の方が酸素と結びつきやすいことがわかりますね。


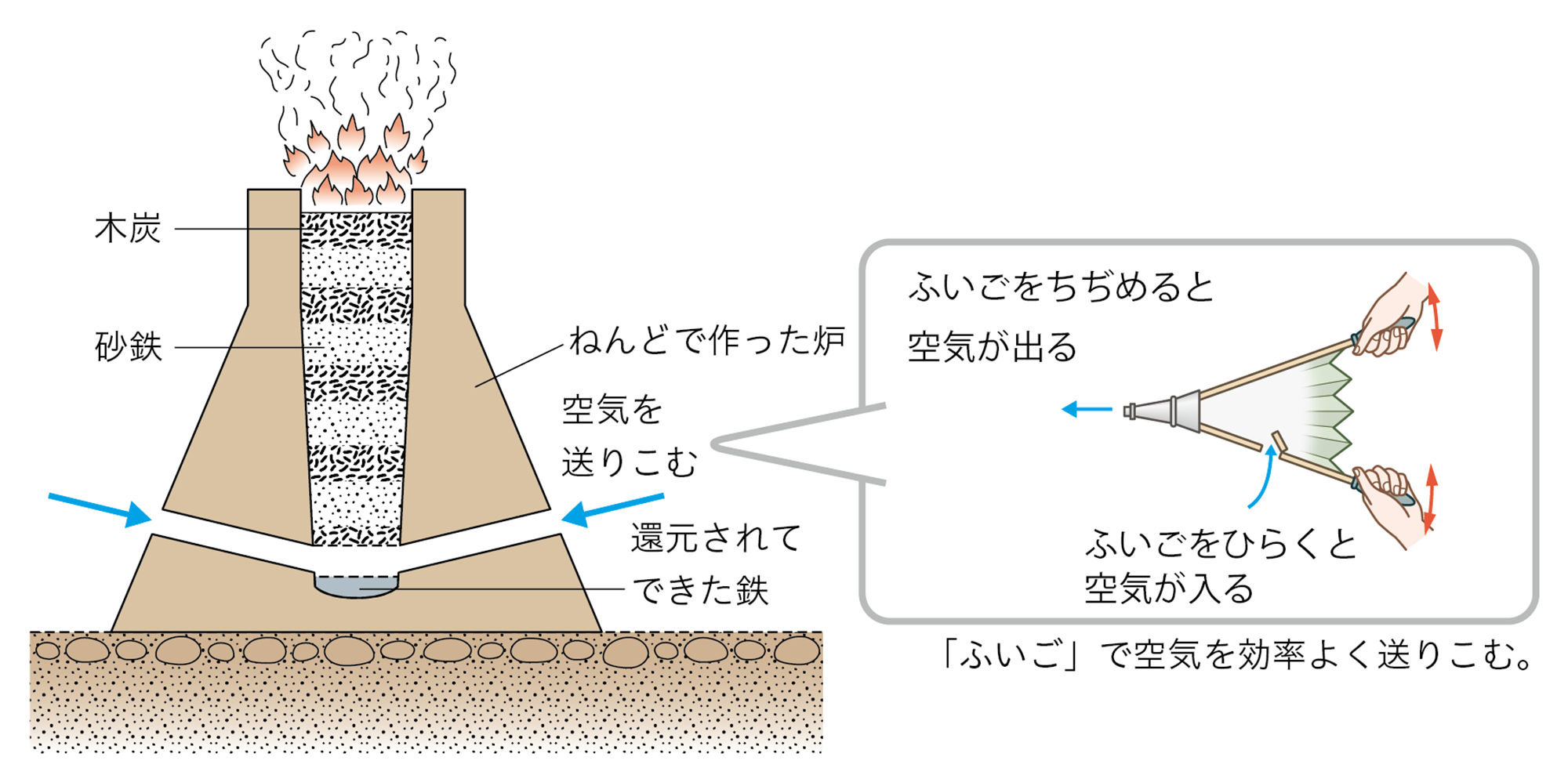
酸化鉄の還元は実験しないのですか?
酸化鉄の還元には,とても高い温度が必要で,ガスバーナーでは火力が足りないのです。

図7 還元の利用-たたら製鉄-