※このウェブページは中学校理科2年の学習内容です。<2年p.60>
2|化学変化と熱
スチールウール(鉄)が酸素中で燃えるときや,マグネシウムが燃えるときは,激しく熱や光を出した。化学変化と熱はどのように関係しているのだろうか。
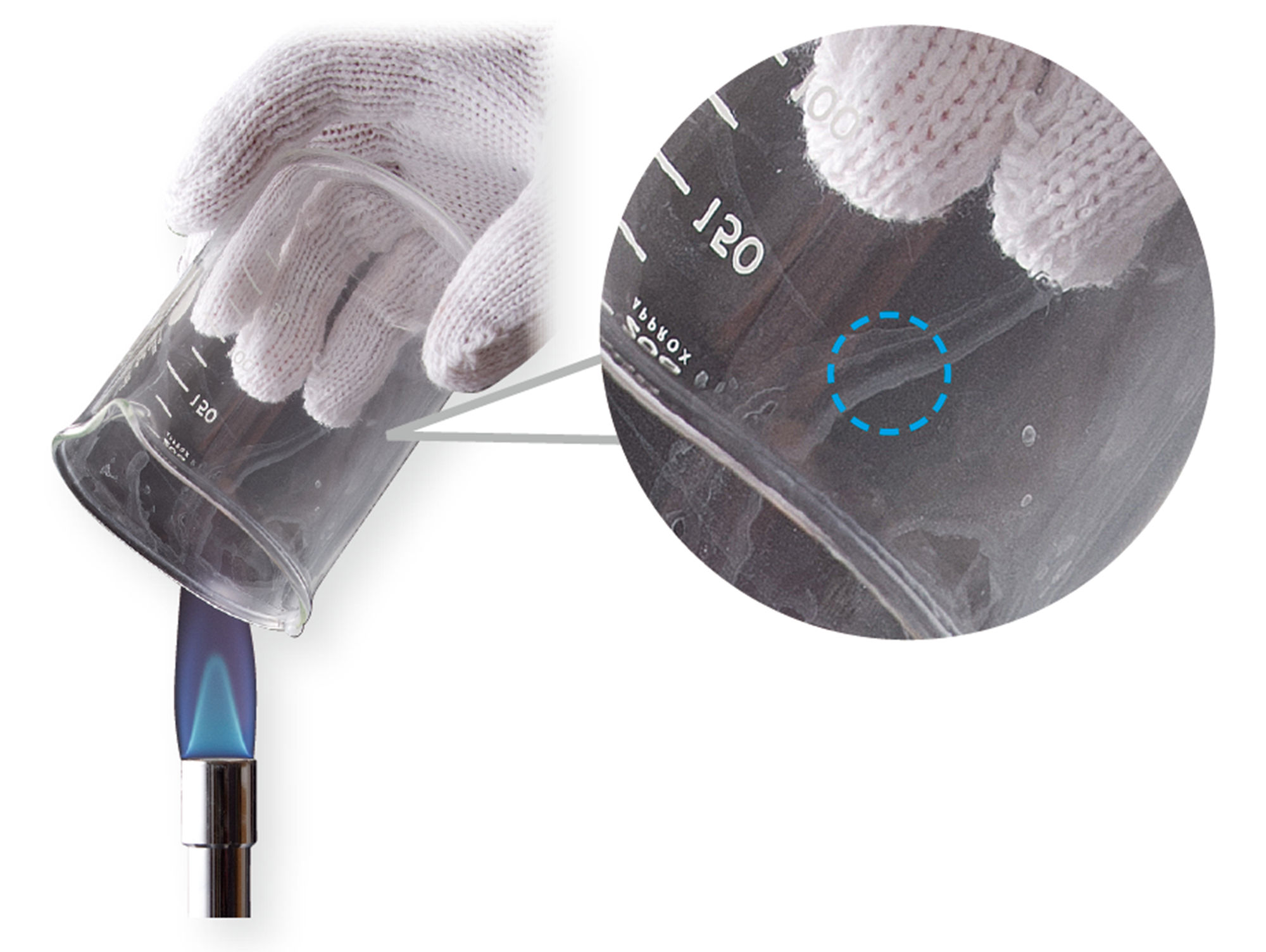
探究8 化学変化にともなう熱の出入り

この実験のそれぞれの薬品は,次のような効果があります。
活性炭 … 粉末状または粒状の炭素で,ここでは化学変化を起こしやすくする。
バーミキュライト … 鉱物の一種で,温度を保つはたらきがある。
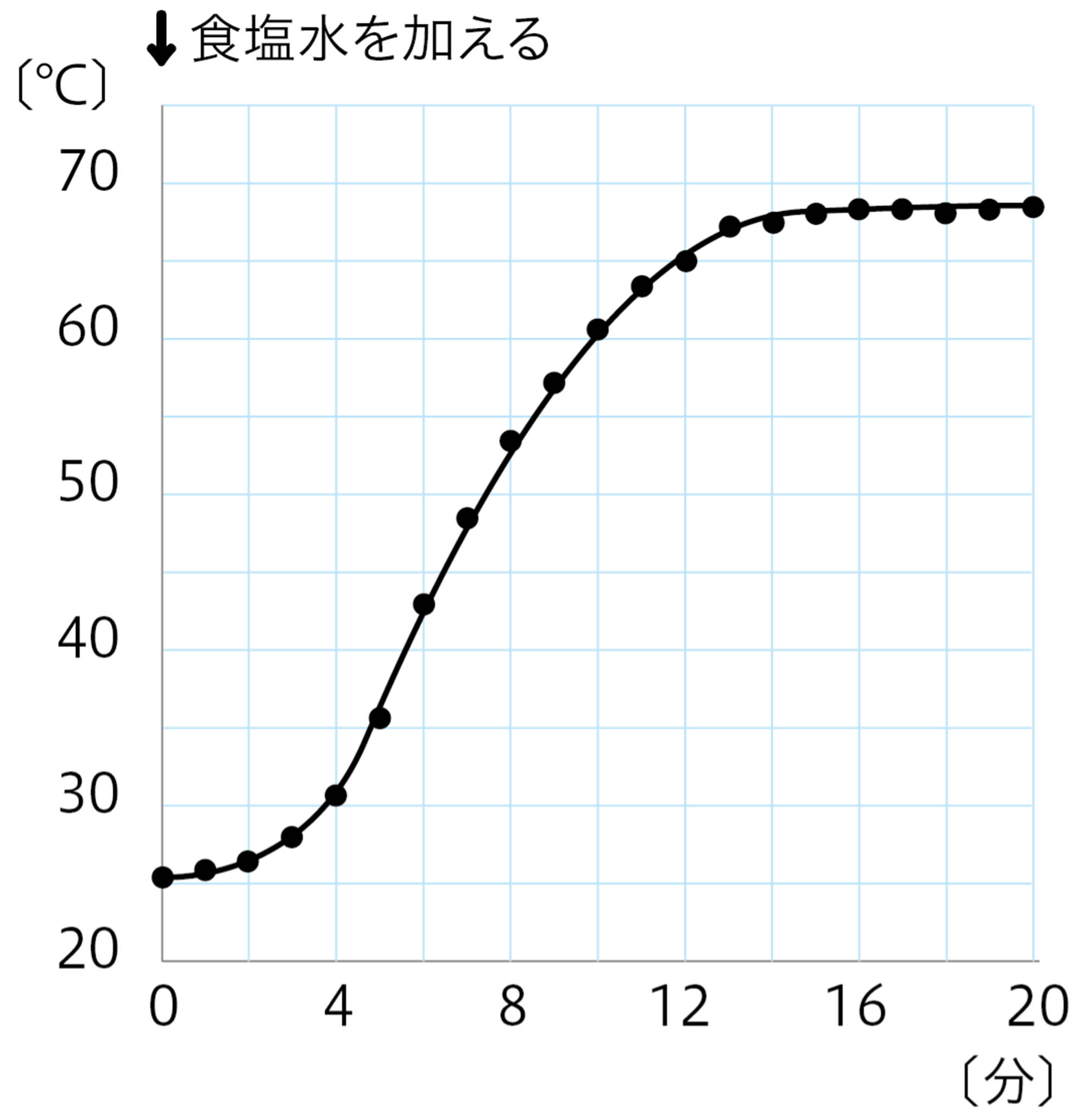
食塩水 … 鉄を酸化させやすくする。
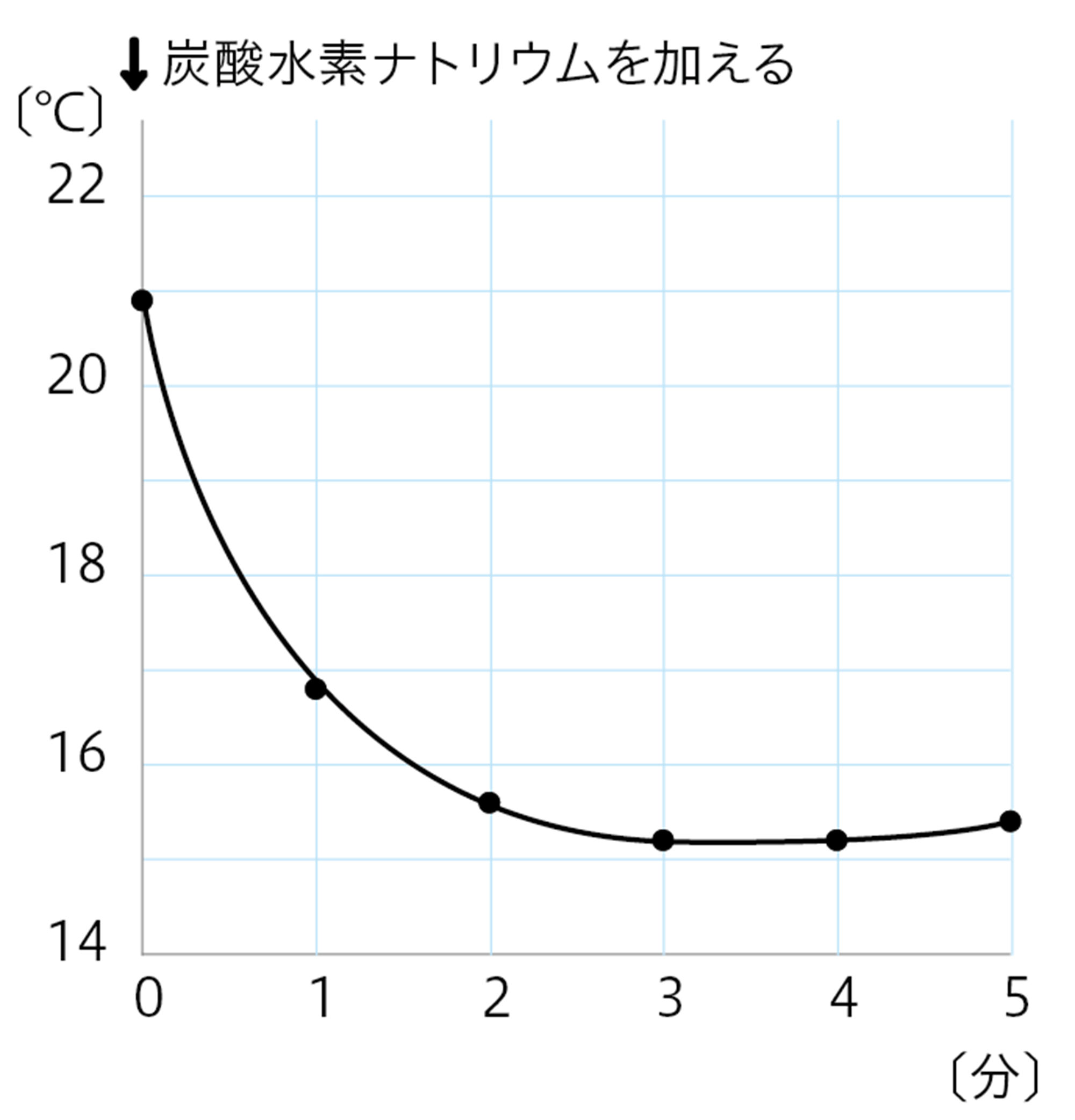
クエン酸水溶液・炭酸水素ナトリウム … 化学変化を起こす。
化学変化のときは,常に熱が発生するんでしょうか?


化学変化はこのように表すことができます。
A 鉄 + 酸素 → 酸化鉄
B クエン酸+炭酸水素ナトリウム → クエン酸ナトリウム + 水 + 二酸化炭素
準備
A 鉄粉,活性炭,バーミキュライト,飽和食塩水,ガラス棒,スポイト
B クエン酸水溶液,炭酸水素ナトリウム
共通 薬さじ,薬包紙,電子てんびん,温度計,ビーカー(50cm³),スタンド,時計,保護めがね
※このウェブページは中学校理科2年の学習内容です。<2年p.61>
1 化学変化と熱
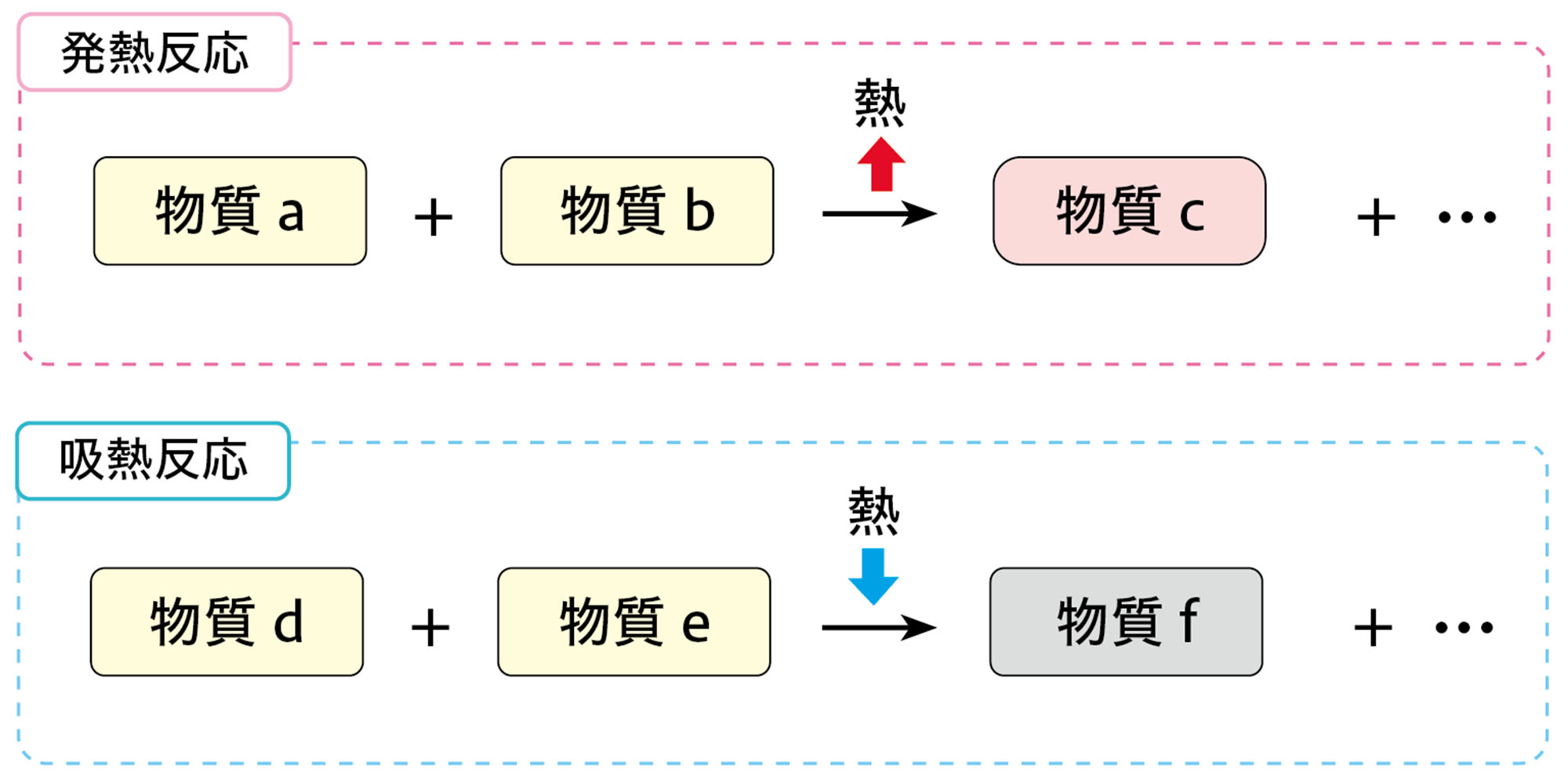
前ページの探究8では,化学変化が起こるときに熱の出入りをともなうことがわかる。このうち,温度が上がる反応を【発熱反応】という。温度が上がるのは,化学変化にともなって熱を外部に放出するからである。また,温度が下がる反応を【吸熱反応】という。温度が下がるのは化学変化をするために熱を必要とし,外部から熱を吸収するからである(図8)。
図9 探究8の結果例
図10 化学変化と熱の利用例
注意!! ここでは説明のために分解している。自分で分解してはいけない。
※このウェブページは中学校理科2年の学習内容です。<2年p.62>
1 熱源としての化学変化
熱が発生する化学変化のうちの一部を,私たちは熱源として利用している。たとえば,私たちは日常生活で,ガス❶や石油などを燃やすときに発生する熱を調理や暖房などに利用している。また,火力発電所では,天然ガスや石油,石炭などを燃やしたときの熱を利用して電気をつくっている。
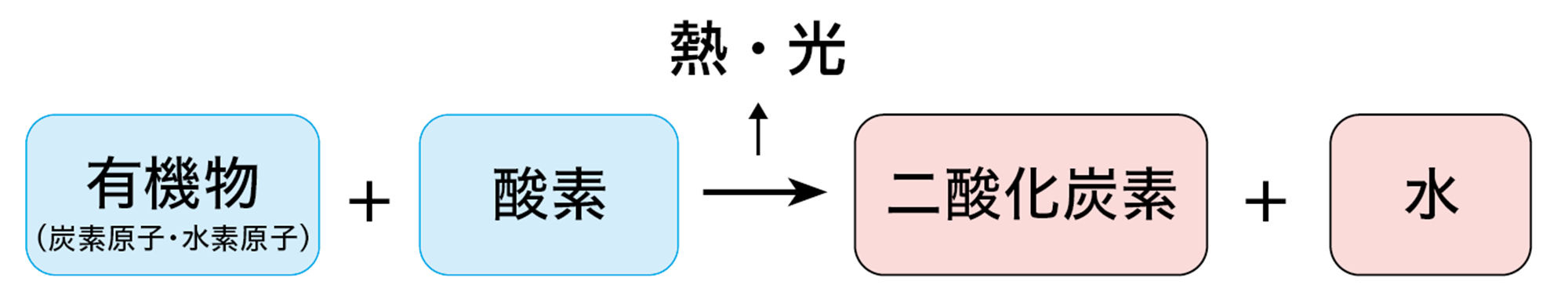
天然ガスや石油,石炭などは有機物であり❷,有機物は炭素Cと水素Hをふくんでいる。このため,燃焼させると,炭素は酸素O₂と結びついて二酸化炭素CO₂になり,水素は酸素と結びついて水H₂Oになる。このとき,熱や光などが出る。
たとえば,都市ガスの主成分であるメタンが燃焼するときの化学反応式は,このように表せます。
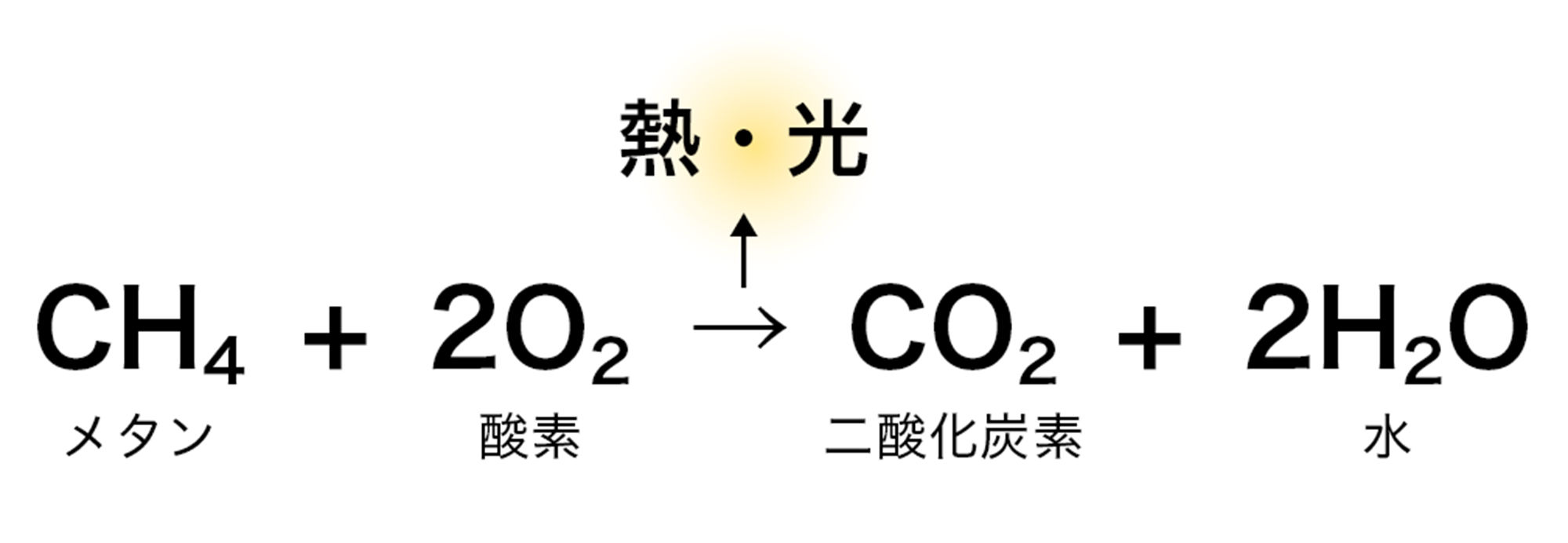

図11 有機物の燃焼
図12 燃料としての化学変化の利用
❶ 都市ガスやプロパンガスがある。
ふりかえり
❷ 炭素をふくむ物質を有機物という。有機物以外の物質を無機物という。ただし,炭素や二酸化炭素は炭素をふくむが無機物である。
有機物の例:砂糖,木,ロウ,エタノール
無機物の例:鉄,食塩,水(中学校1年)