※このウェブページは中学校理科3年の学習内容です。<3年p.154>
2|電池
1 化学電池
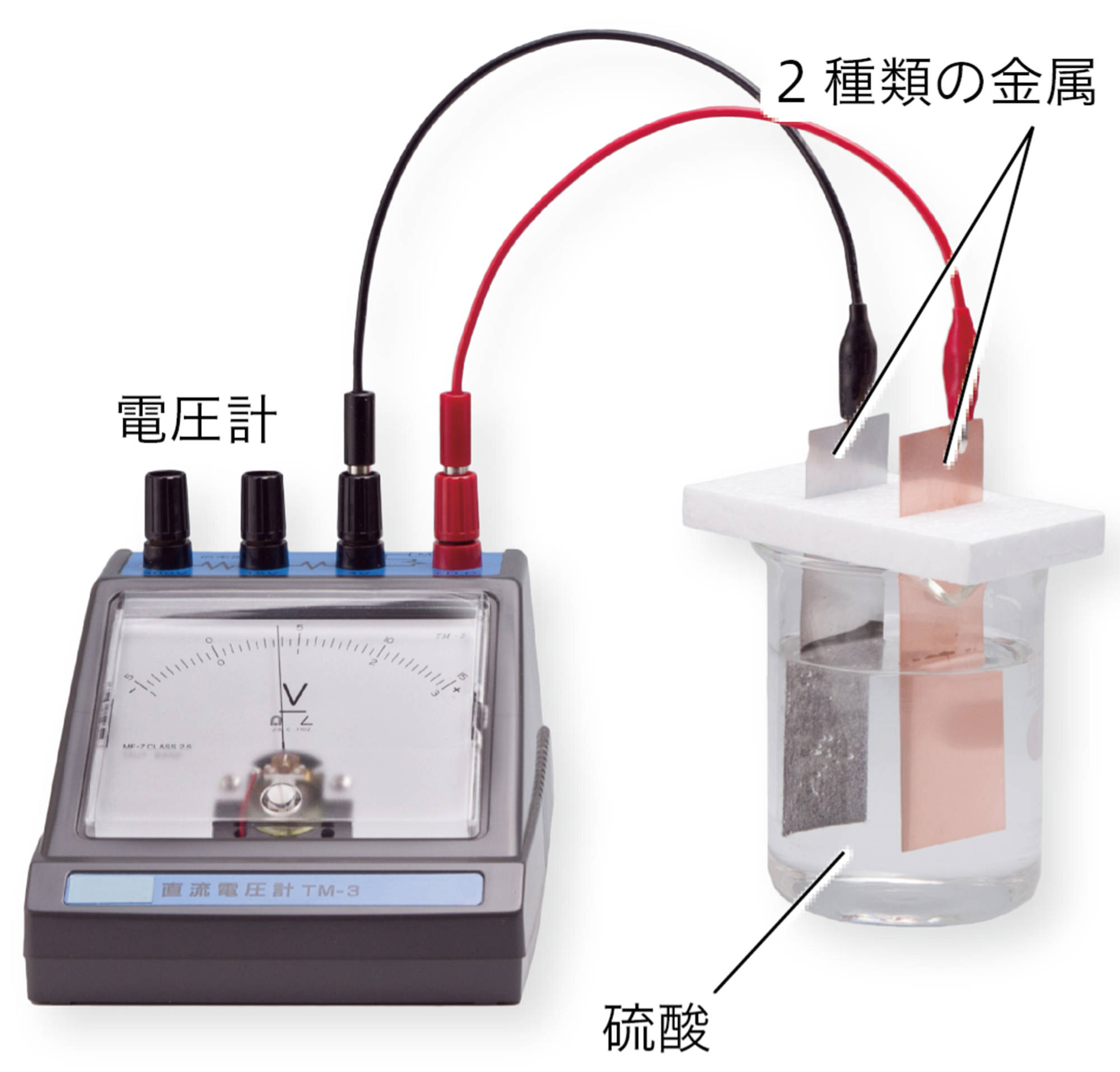
図11のように,電解質の水溶液に2種類の金属板をひたして導線をつなぐと,電圧が生じる。このとき,それぞれの金属板では,金属が溶けたり,物質が生じたりする化学変化が起こる。化学変化を利用して電流を取り出す装置を【化学電池】という。
2 ダニエル電池
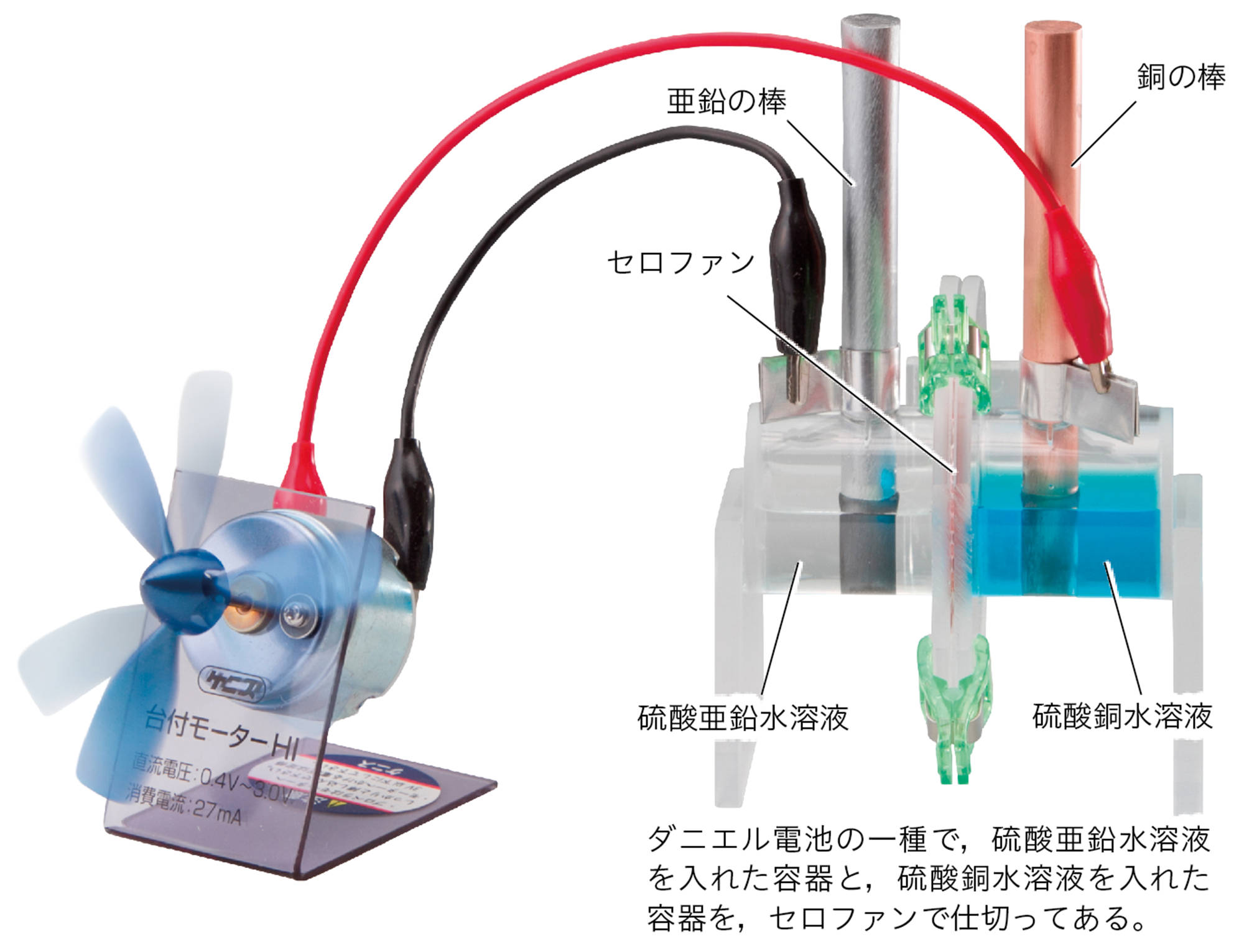
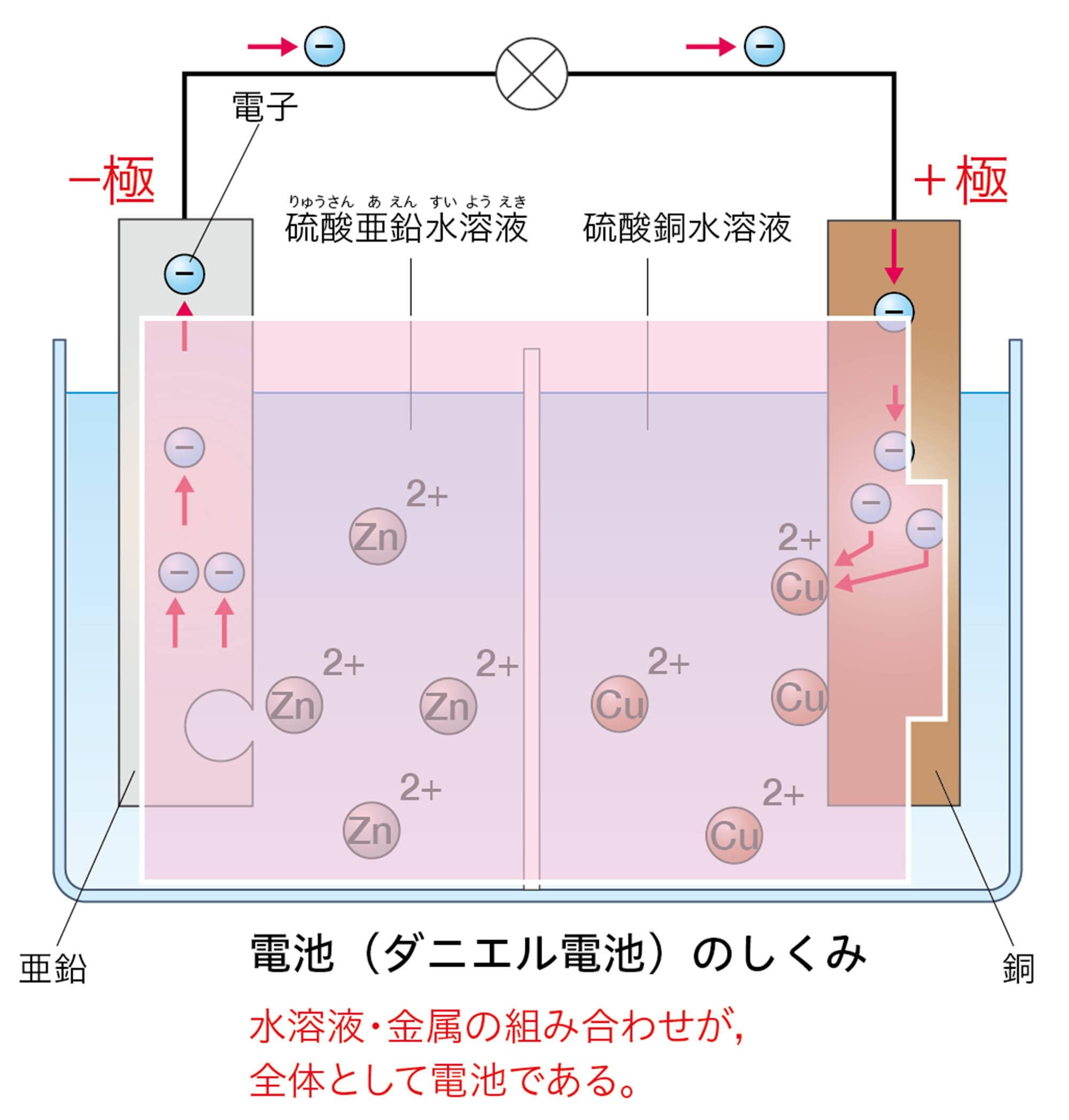
+極と-極となる金属板や,水溶液の組み合わせを変えて化学電池を改良し,長時間電流を取り出せるようにした装置がダニエル電池である。
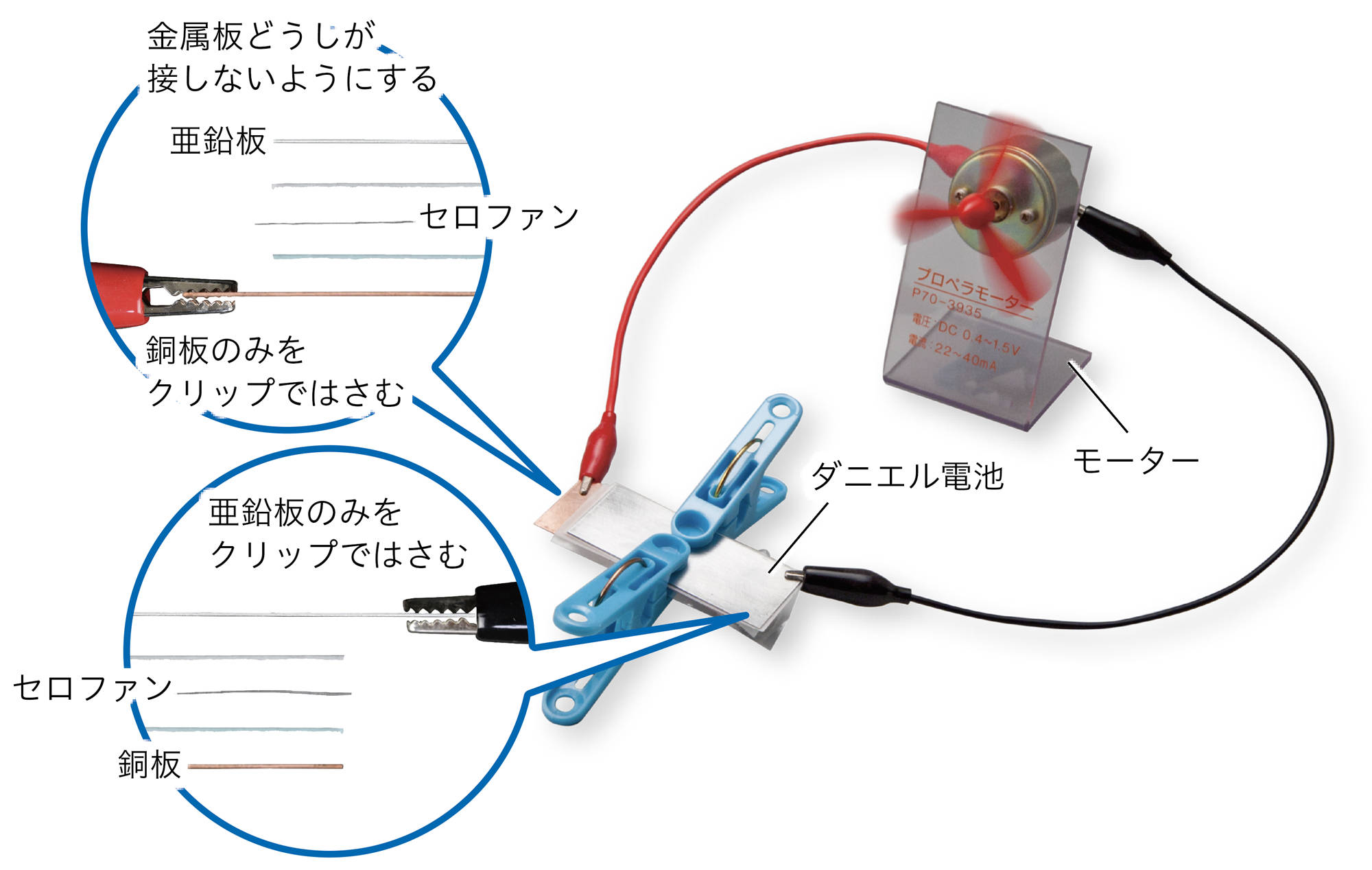
探究6 ダニエル電池をつくる
準備
亜鉛板,銅板,硫酸亜鉛水溶液(1%),硫酸銅水溶液(5%),ろ紙,セロファン,モーター(低電圧用),バット,ピンセット,クリップつき導線,洗濯ばさみ,保護めがね
注意!! 実験のときは保護めがねをかける。

この実験で使用する硫酸亜鉛の化学式はZnSO₄,硫酸銅の化学式はCuSO₄です。
※このウェブページは中学校理科3年の学習内容です。<3年p.263>
資料 電池の発明
イタリアの物理学者ボルタは,2種類の金属と食塩水などの水溶液があれば,電流を連続的に取り出せることを発見し,「ボルタの電堆(図(a))」とよばれる装置を作りました(1800年)。これが世界ではじめての電池です。
ボルタの発明によって,それまで得ることが難しかった,連続した電流が得られるようになりました。そして,水の電気分解や電流についての実験などが行われるようになり,多くの発見や発明につながりました。しかし,ボルタの電池は,電圧がすぐ下がってしまうことや,装置も大きく,たおれると液がこぼれるなどの欠点がありました。
その後,ボルタの電池の改良が進められ,1880年代に日本の屋井先蔵(新潟県長岡市)やドイツのガスナー(1855〜1942年)は,水溶液を固めた,液がこぼれない電池を発明しました(図(b))。このしくみは,液がこぼれない,乾いた電池なので「乾電池」とよばれています。
※このウェブページは中学校理科3年の学習内容です。<3年p.155>
「探究6」のようにダニエル電池をつくると,電流を取り出せることがわかる。電流は電子の移動であることをもとにすると,ダニエル電池でも電子の移動が起こっていることが予想される。このしくみを原子のモデルで理解しようとしたとき,どのように科学的に説明できるだろうか。
探究7 ダニエル電池の原理

ダニエル電池のしくみを使って電流を取り出し続けると,電極の金属は右のように変化しました。この結果をもとに,化学電池の原理をイオンの化学式で説明しましょう。

セロファンには,目に見えない小さな穴(直径0.000002mm)があいています。
図13 ダニエル電池の電極の変化
ダニエル電池はどのようなしくみで電流を取り出しているのか。電極の変化に注目して考える。
※このウェブページは中学校理科3年の学習内容です。<3年p.156>
探究7 結果から考察する
・硫酸銅の電離のようすは次のように考えられる。
CuSO₄ → Cu²⁺ + SO₄²⁻
・硫酸亜鉛の電離のようすは次のように考えられる。
ZnSO₄ → Zn²⁺ + SO₄²⁻
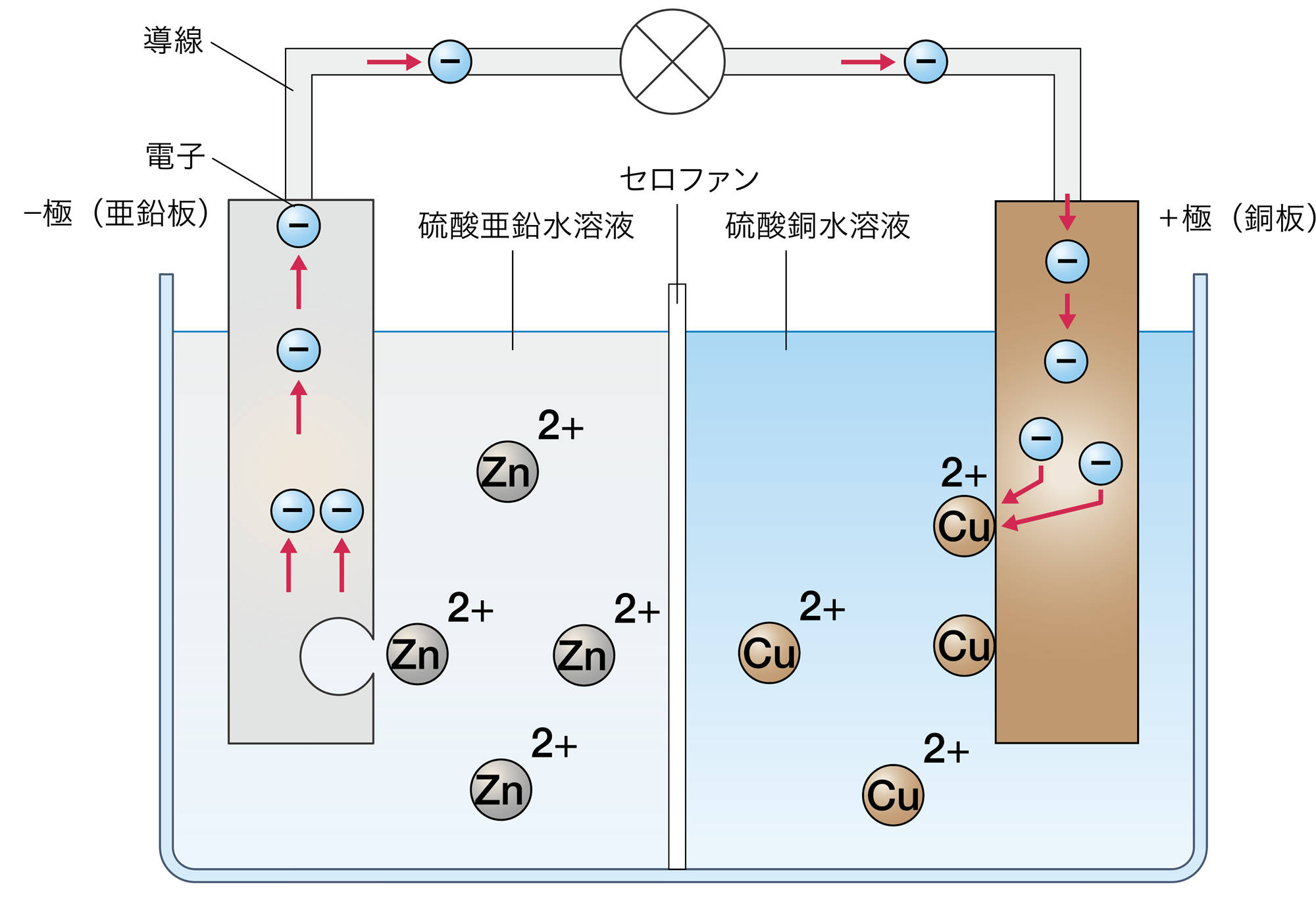
硫酸銅水溶液の中の銅イオンが,+極で電子を受け取って金属になり,同時に金属の亜鉛が硫酸亜鉛水溶液に溶けるときに電子を-極に残しているんだね。

そうか!2年生のときはコイルと磁石を使った「発電機」で電流を取り出すことを学習して,今は化学変化によって電流を取り出す「電池」を学習したんだね。電流を取り出す方法には2種類あるんだね。

- 銅の電極の変化から,硫酸銅水溶液中の銅イオンが,金属の銅になったと考えられる。このとき,銅イオンが電子を受け取るはずである。
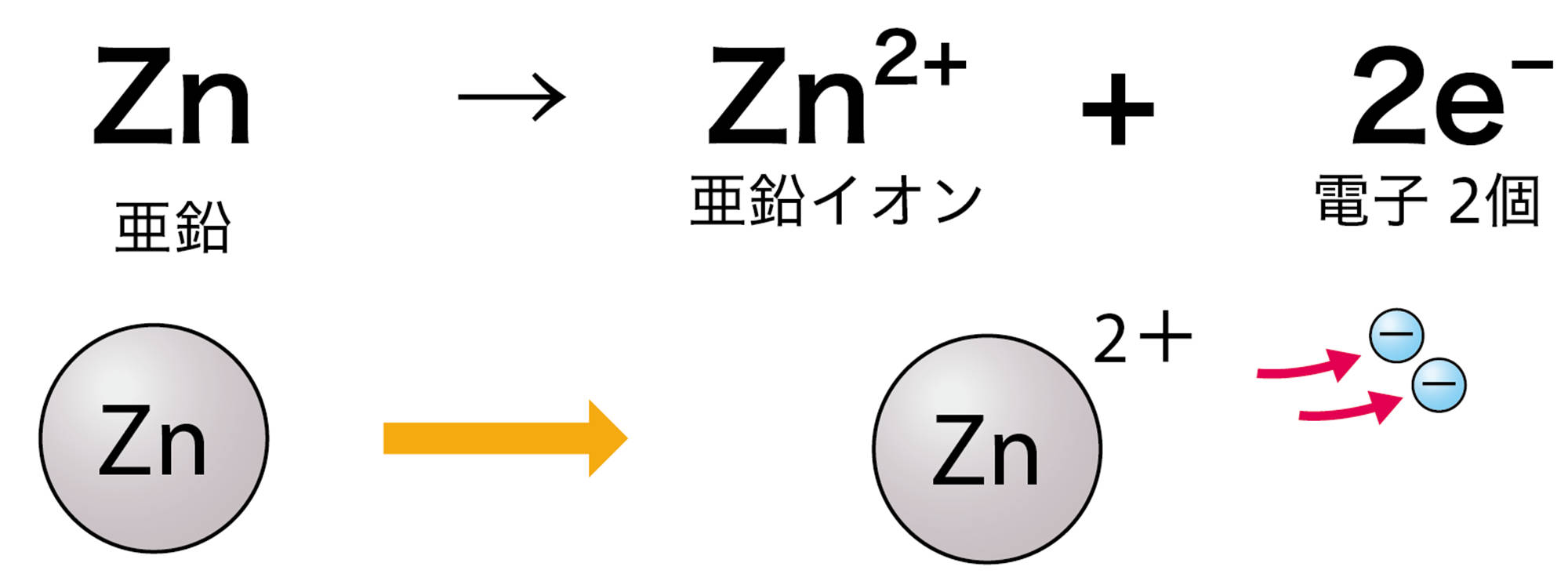
- 亜鉛の電極の変化から,亜鉛が硫酸亜鉛水溶液に溶けたと考えられる。
- p.149図5をあてはめて考えると,亜鉛が亜鉛イオンになるとき,電極の中に電子を残すと考えられる。
- 亜鉛の電極に残った電子は,導線を通って銅の電極に移動し,そこで銅イオンが電子を受け取ったと考えると,全体がうまく説明できる。
※このウェブページは中学校理科3年の学習内容です。<3年p.157>
ダニエル電池は図15のような原理で,亜鉛から銅への電子の流れが生じることで,電流が生じる。ダニエル電池などの化学電池は,物質がもっている化学エネルギーを電気エネルギーに変換している。

硫酸イオン(SO₄²⁻)はここでの化学変化に関わっていないため,省略しています。

電池のしくみは電気分解と似てるよね。何がちがうのかわからなくなりそう。
電気分解は電源に金属板をつなぐけど,ダニエル電池の場合は,このしくみそのものが電源なんだね。


セロファンの役割については,p.263で説明しています。
※このウェブページは中学校理科3年の学習内容です。<3年p.261>
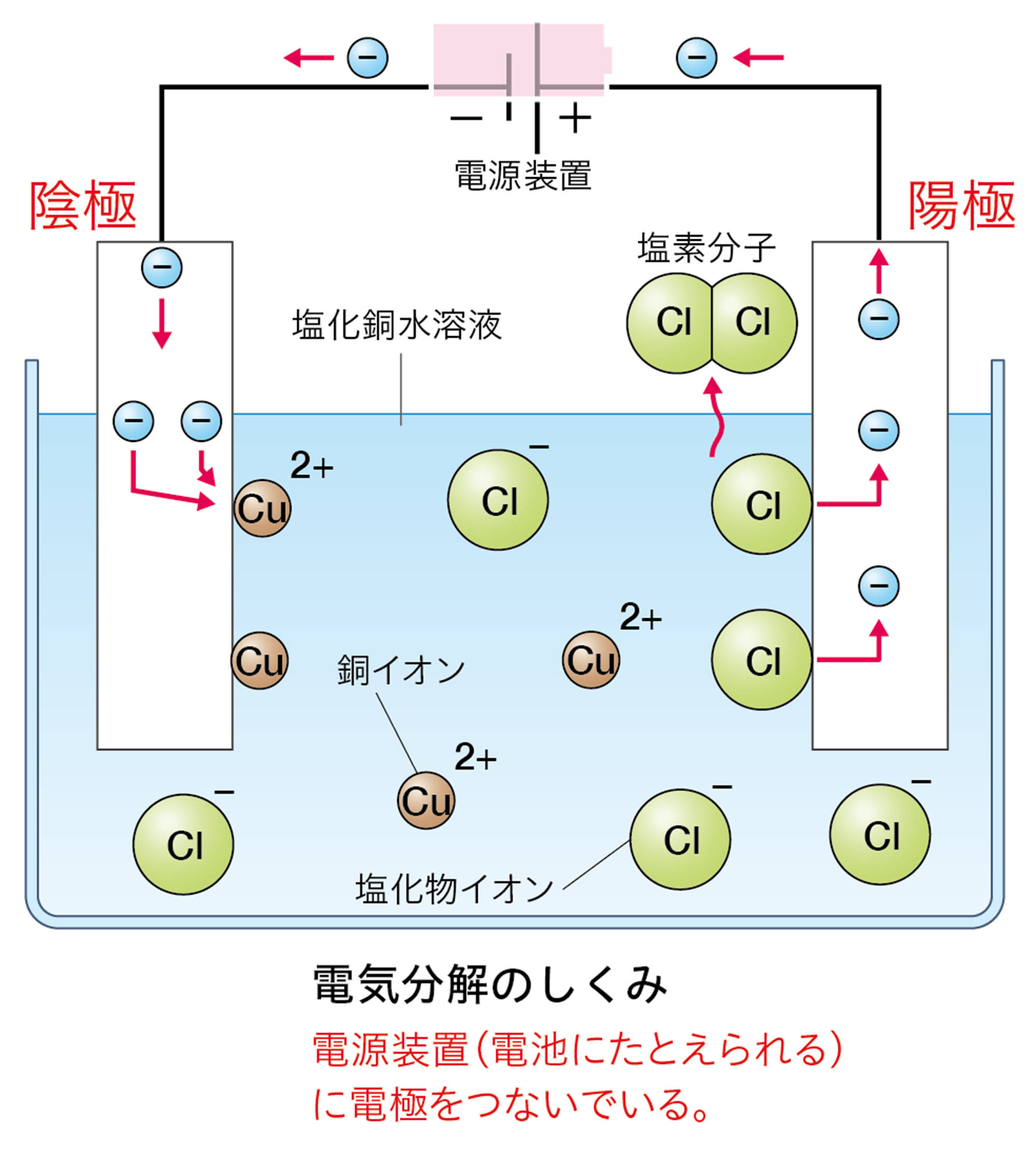
発展 電気分解と電池は何がちがう
塩化銅CuCl₂は水に溶かすと次のように電離する。
CuCl₂ → Cu²⁺ + 2Cl⁻
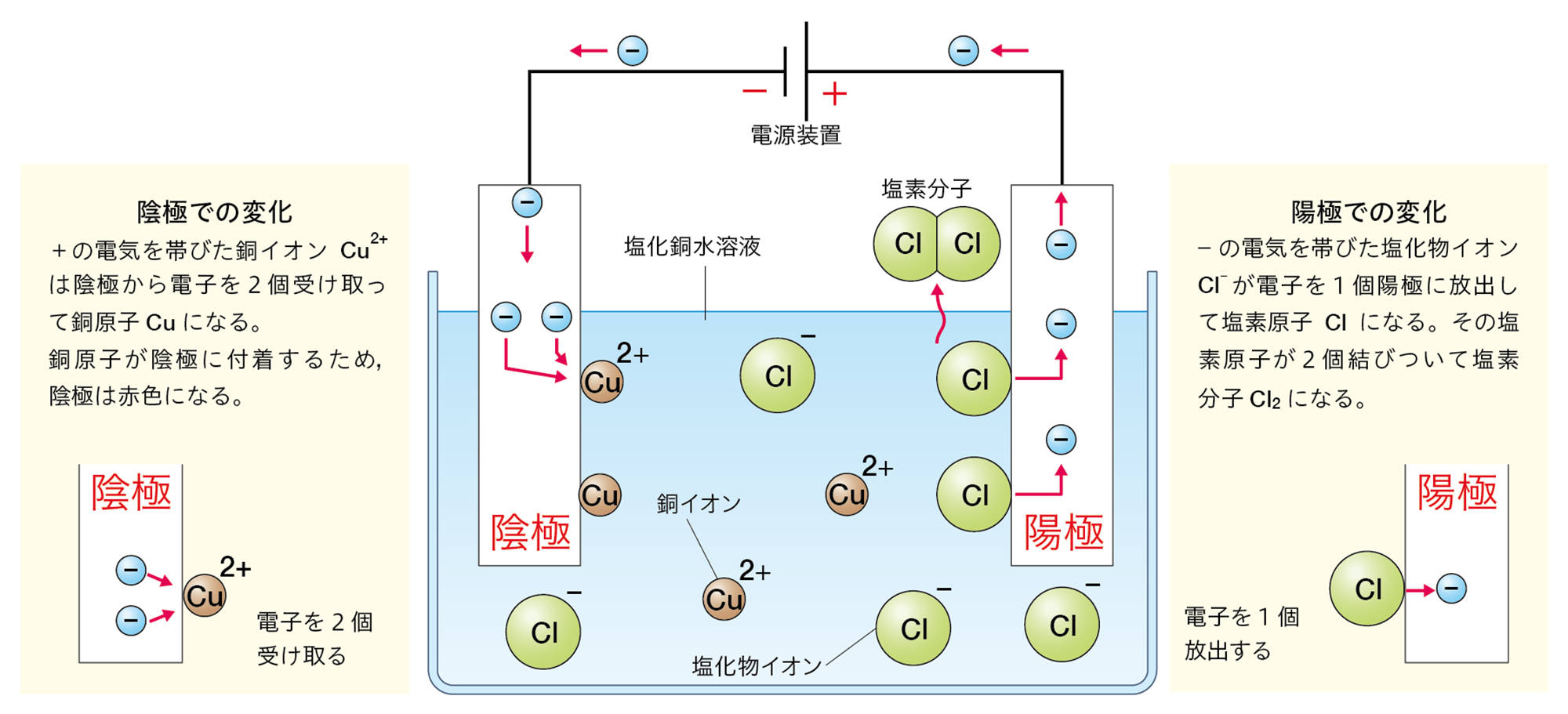
この水溶液に電極を入れて電流を流したとき,電源装置の−極から電子が流れ出し,陰極に流れこむ。
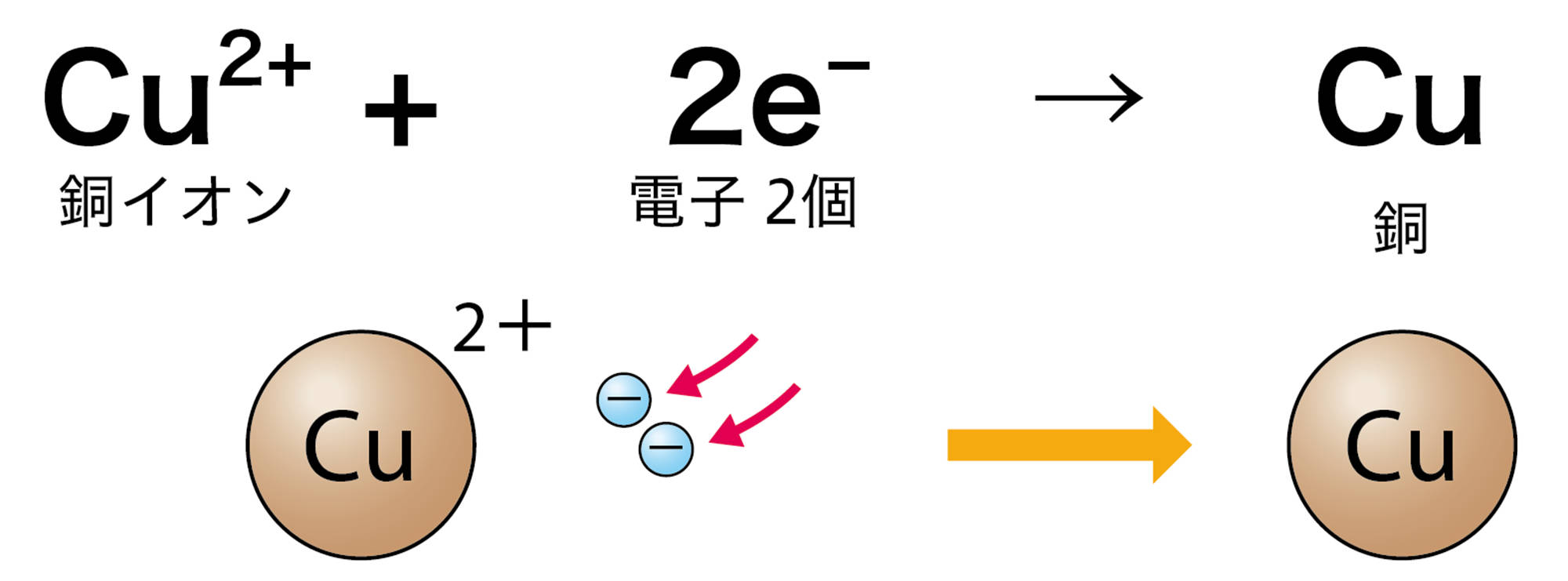
水溶液中の銅イオンCu²⁺は,陰極で電源装置の−極から流れてきた電子2個を受け取って銅原子Cuになる。そのときのようすはイオンの化学式を使って次のように表す。
Cu²⁺ + 2e− → Cu
水溶液中の塩化物イオンCl⁻は,陽極で電子1個を放出して塩素原子Clになる。そのときのようすはイオンの化学式を使って次のように表す。
Cl⁻ → Cl + e−
塩素原子2個が結びついて塩素分子Cl₂になる。また,放出された電子は陽極から電源装置の+極に向かって流れる。

「電気分解のしくみ」を「電池」とまちがえやすいのですが,下のように異なります。電池では,電子が流れこむ方が「+極」,電子が流れ出す方が「−極」です。電気分解では,電池の+極に接続した電極が「陽極」,−極に接続した電極が「陰極」です。
電子の流れ,電極での電子のやり取りのちがいに注目しましょう。

※このウェブページは中学校理科3年の学習内容です。<3年p.263>
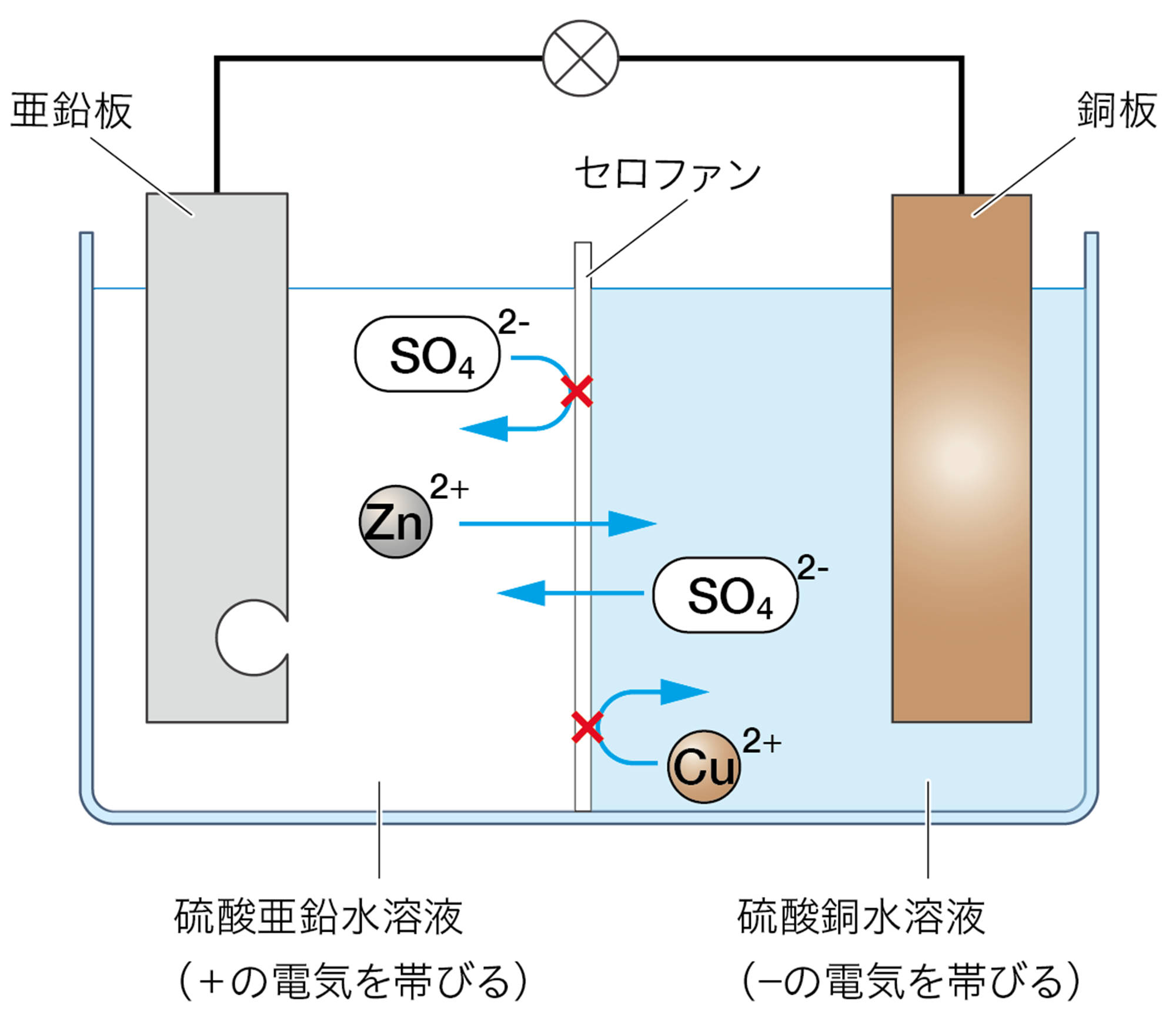
資料 ダニエル電池に使うセロファンのはたらき
セロファンには硫酸亜鉛水溶液と硫酸銅水溶液をわけるはたらきがあります。下図のように,セロファンが仕切りになり,左側の液が+の電気を帯びると,銅イオンは左側に広がっていくことができません。もしセロファンがなければ,銅イオンは亜鉛板に接して銅が生じるため,電流は流れません。
❶ 反応が進むと,硫酸亜鉛水溶液には亜鉛イオン(Zn²⁺)が増え,しだいに+の電気を帯びていく。硫酸銅水溶液には銅イオン(Cu²⁺)が減ってしだいに−の電気を帯びていく。
❷ 硫酸亜鉛水溶液中のZn²⁺は,−の電気を帯びた硫酸銅水溶液に引きつけられ,セロファンを通って硫酸銅水溶液中に広がっていくことができる。
❸ 硫酸銅水溶液中のSO₄²⁻は,+の電気を帯びた硫酸亜鉛水溶液に引きつけられ,セロファンを通って硫酸亜鉛水溶液中に広がっていくことができる。
❹ 硫酸銅水溶液中のCu²⁺は,+の電気を帯びた硫酸亜鉛水溶液に反発し,硫酸亜鉛水溶液中に広がっていきにくい。
❺ 硫酸亜鉛水溶液中のSO₄²⁻は,−の電気を帯びた硫酸銅水溶液に反発し,硫酸銅水溶液中に広がっていきにくい。
ニュース
- 3-3-3-2 2023年1月1日この節に関わるニュースはまだありません。