gkt-horizontal-line
※このウェブページは中学校理科3年の学習内容です。<3年p.261>
発展 電気分解と電池は何がちがう
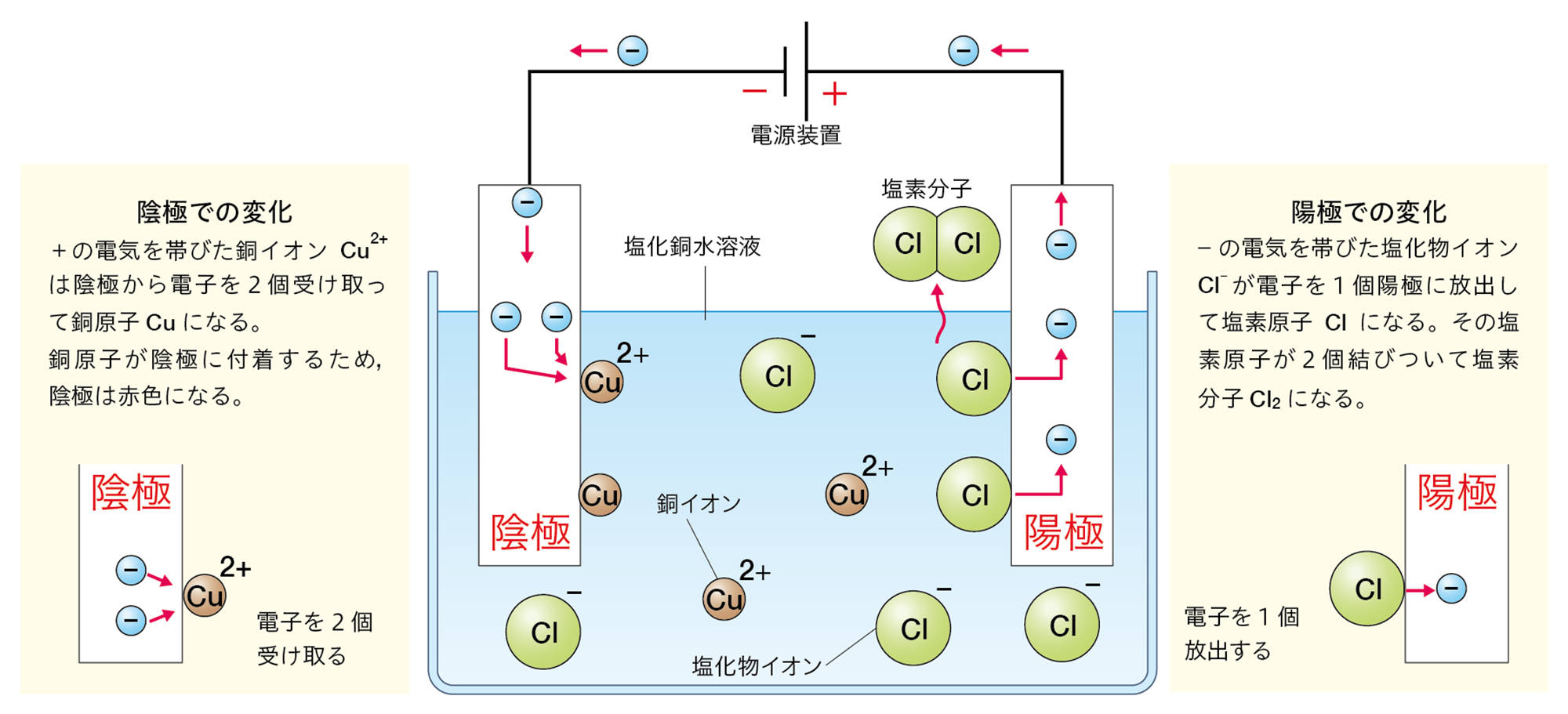
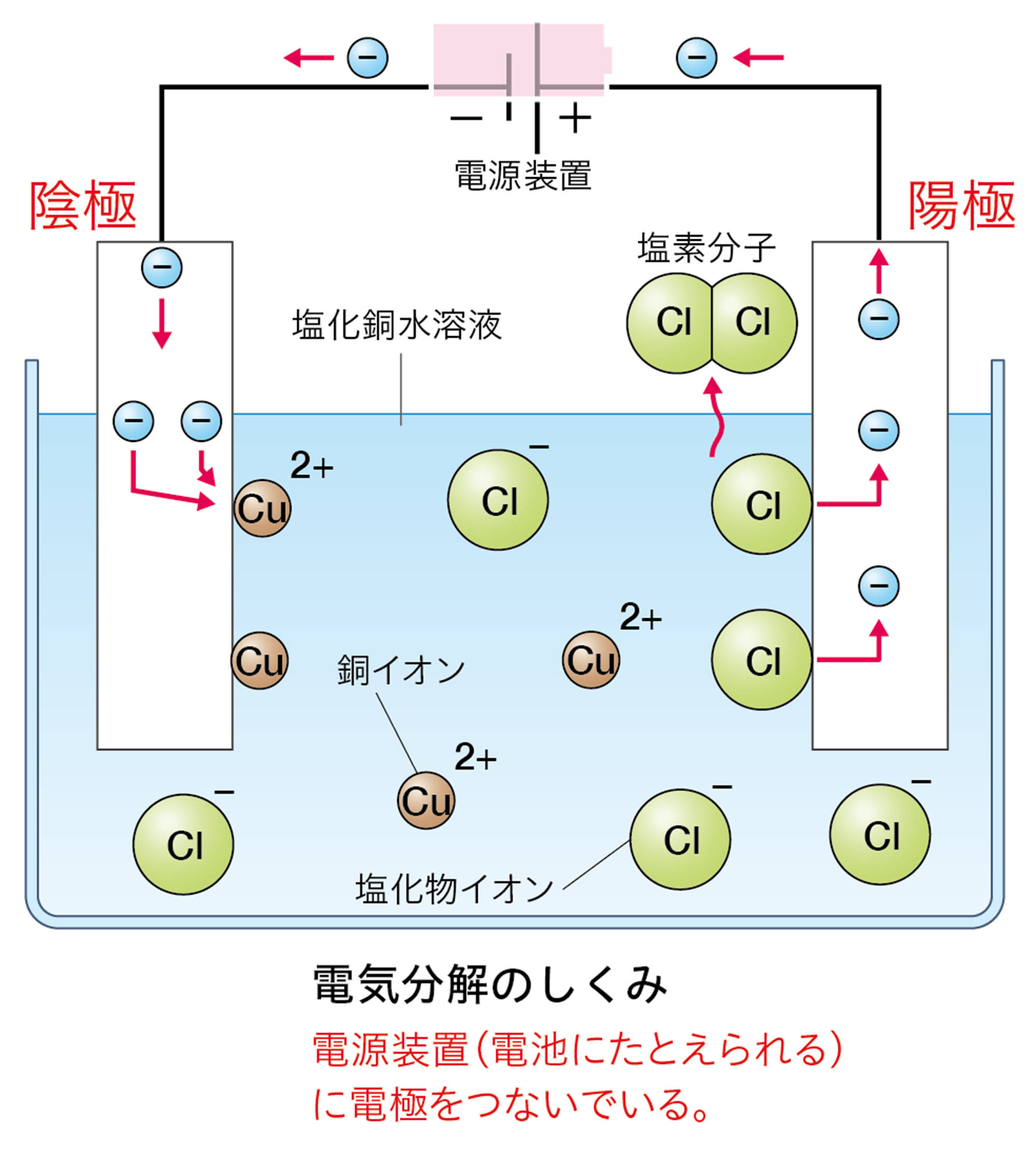
塩化銅CuCl₂は水に溶かすと次のように電離する。
CuCl₂ → Cu²⁺ + 2Cl⁻
この水溶液に電極を入れて電流を流したとき,電源装置の−極から電子が流れ出し,陰極に流れこむ。
水溶液中の銅イオンCu²⁺は,陰極で電源装置の−極から流れてきた電子2個を受け取って銅原子Cuになる。そのときのようすはイオンの化学式を使って次のように表す。
Cu²⁺ + 2e− → Cu
水溶液中の塩化物イオンCl⁻は,陽極で電子1個を放出して塩素原子Clになる。そのときのようすはイオンの化学式を使って次のように表す。
Cl⁻ → Cl + e−
塩素原子2個が結びついて塩素分子Cl₂になる。また,放出された電子は陽極から電源装置の+極に向かって流れる。

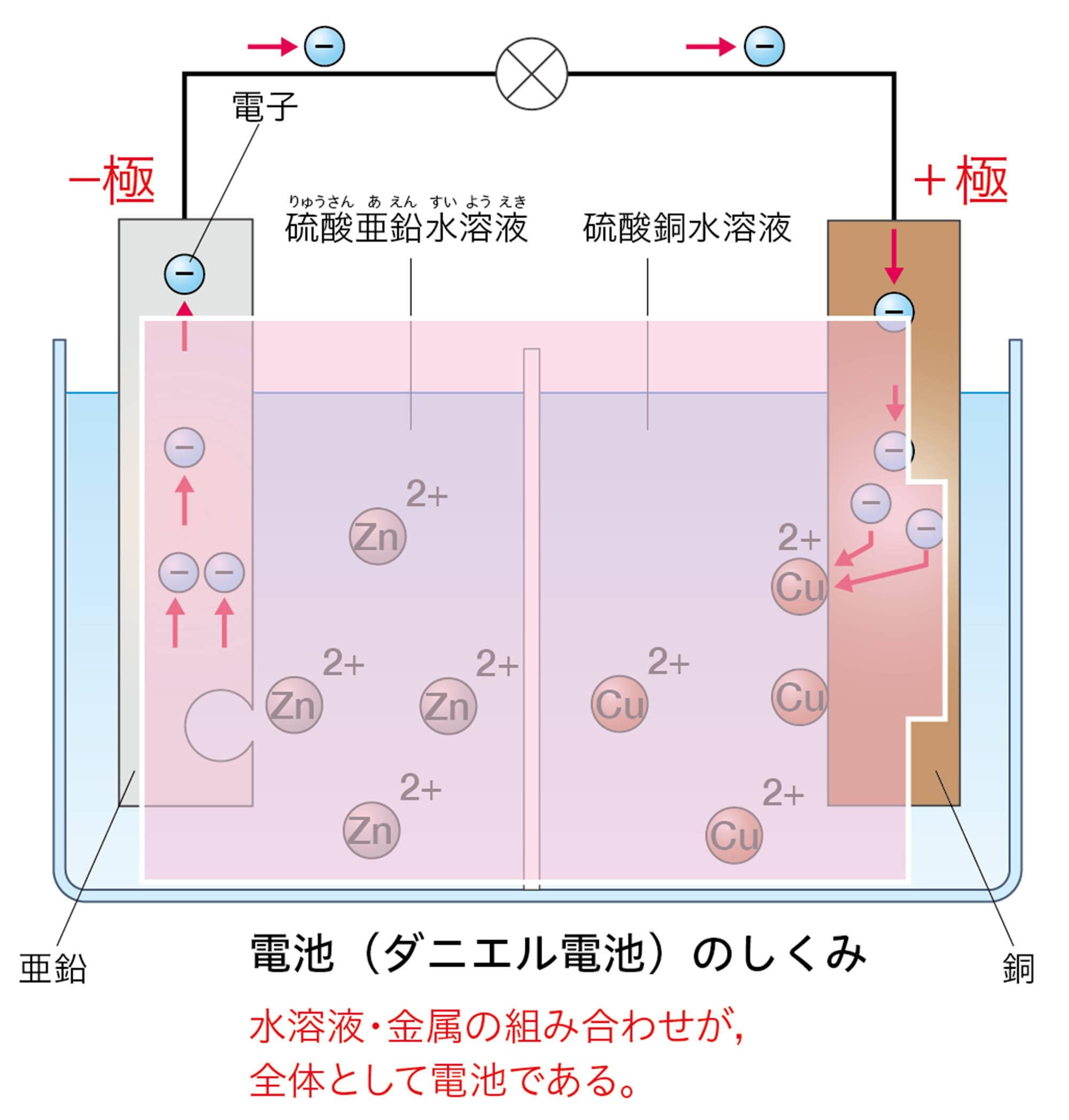
「電気分解のしくみ」を「電池」とまちがえやすいのですが,下のように異なります。電池では,電子が流れこむ方が「+極」,電子が流れ出す方が「−極」です。電気分解では,電池の+極に接続した電極が「陽極」,−極に接続した電極が「陰極」です。
電子の流れ,電極での電子のやり取りのちがいに注目しましょう。