gkt-horizontal-line
※このウェブページは中学校理科3年の学習内容です。<3年p.118>
1|電解質
1 原子の構造
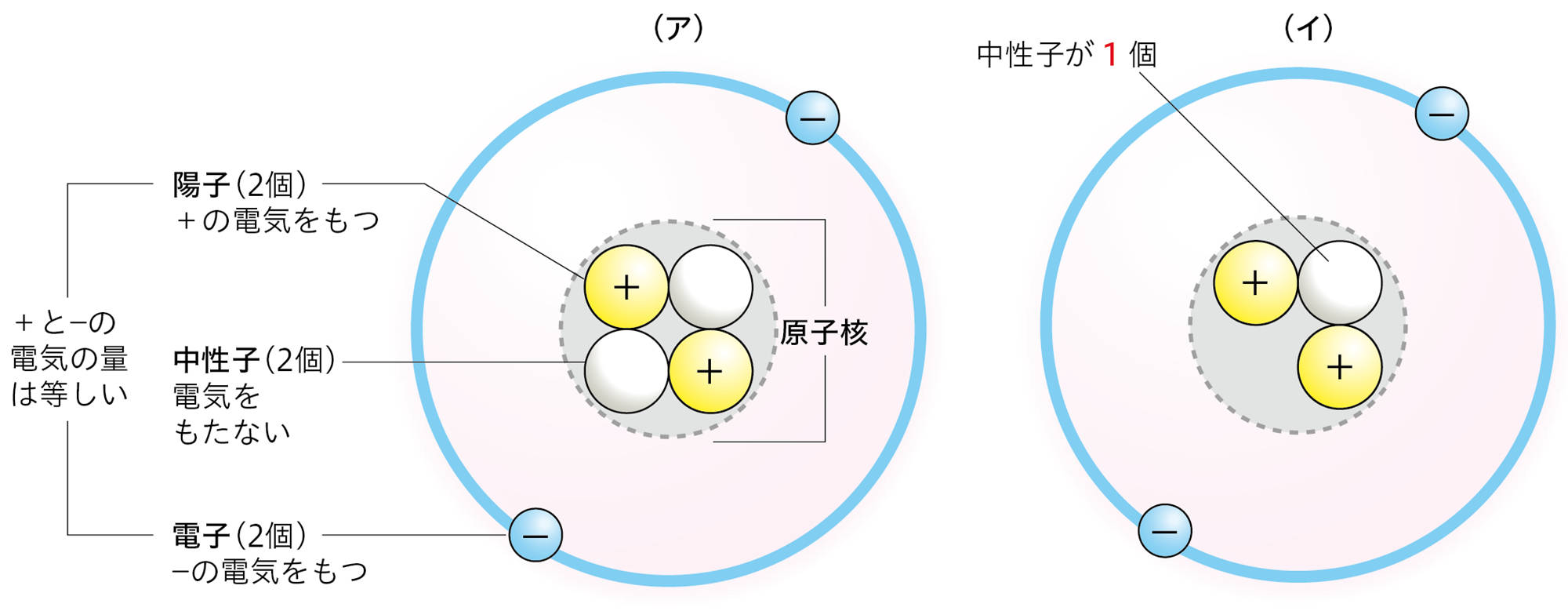
原子は,図1(ア)のように+の電気をもつ原子核と,− の電気をもつ電子からできている❶。原子核は,原子の中心にあり,そのまわりに電子が存在する。また,原子核は,+の電気をもつ陽子と,電気をもたない中性子が集まってできている。
陽子1個がもっている+の電気の量と,電子1個がもっている − の電気の量は等しい。原子の中の陽子の数と電子の数が等しいので,原子全体としては陽子と電子がたがいの電気を打ち消し合い,電気を帯びていない状態になっている。
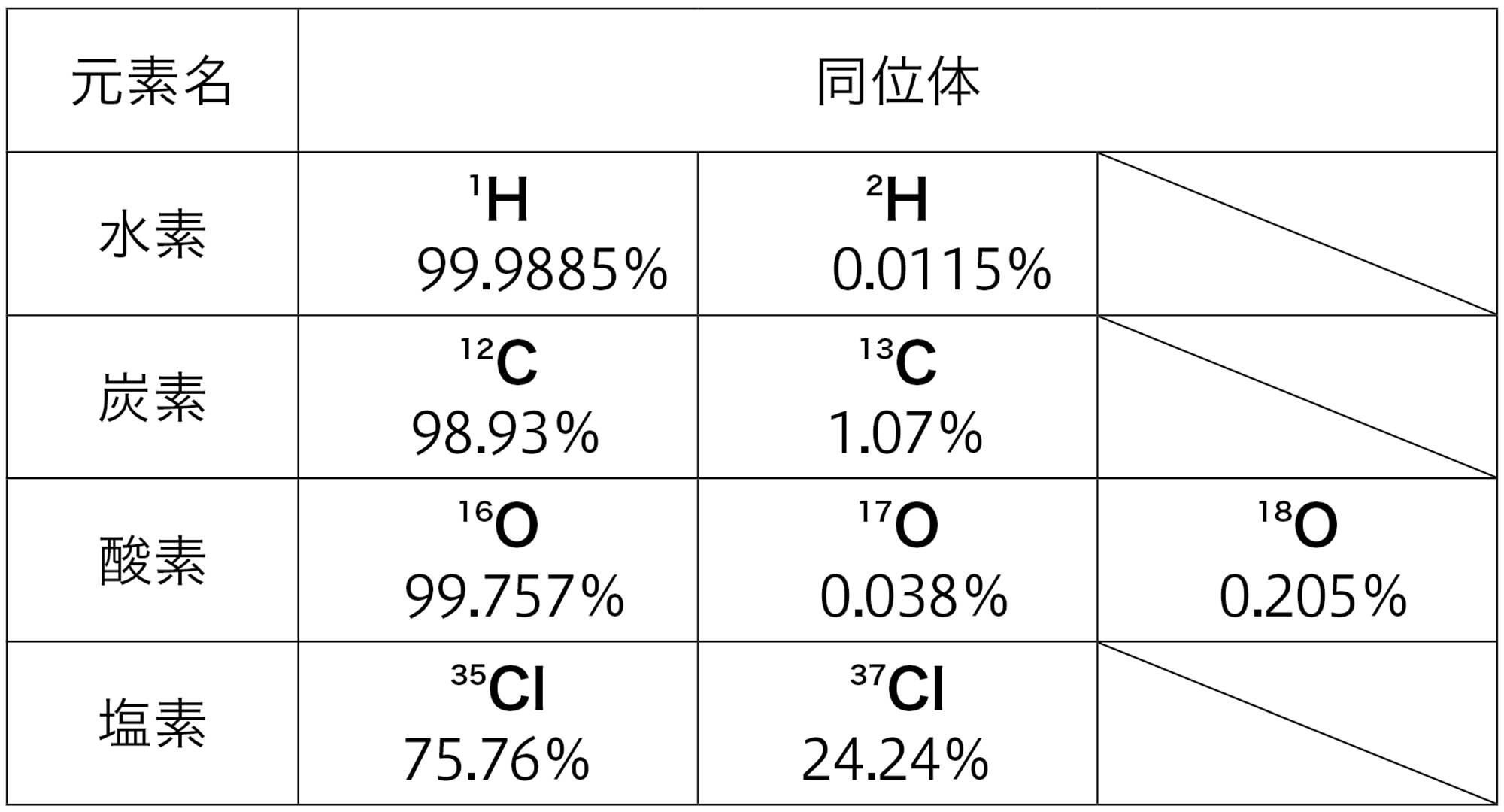
また,同じ元素であっても,原子によっては中性子の数が異なることがある(図1(ア)(イ))。このような原子どうしを同位体という。原子核の陽子の数が同じであれば,原子の性質はほぼ同じである。
2年生で学習した「元素」とは,同位体をまとめてよぶときの用語です。元素の化学的性質は陽子の数にもとづいて決まります。

❶ 静電気は物質の間を電子が移動することによって起こる。また,導線の中には自由に動ける電子があり,これが電流の正体である。このような現象が起こるのは,原子が電子をもっているからである。
❷ 出典:NIST Physical Measurement Laboratory