gkt-horizontal-line
※このウェブページは中学校理科3年の学習内容です。<3年p.128>
3 電解質とイオン
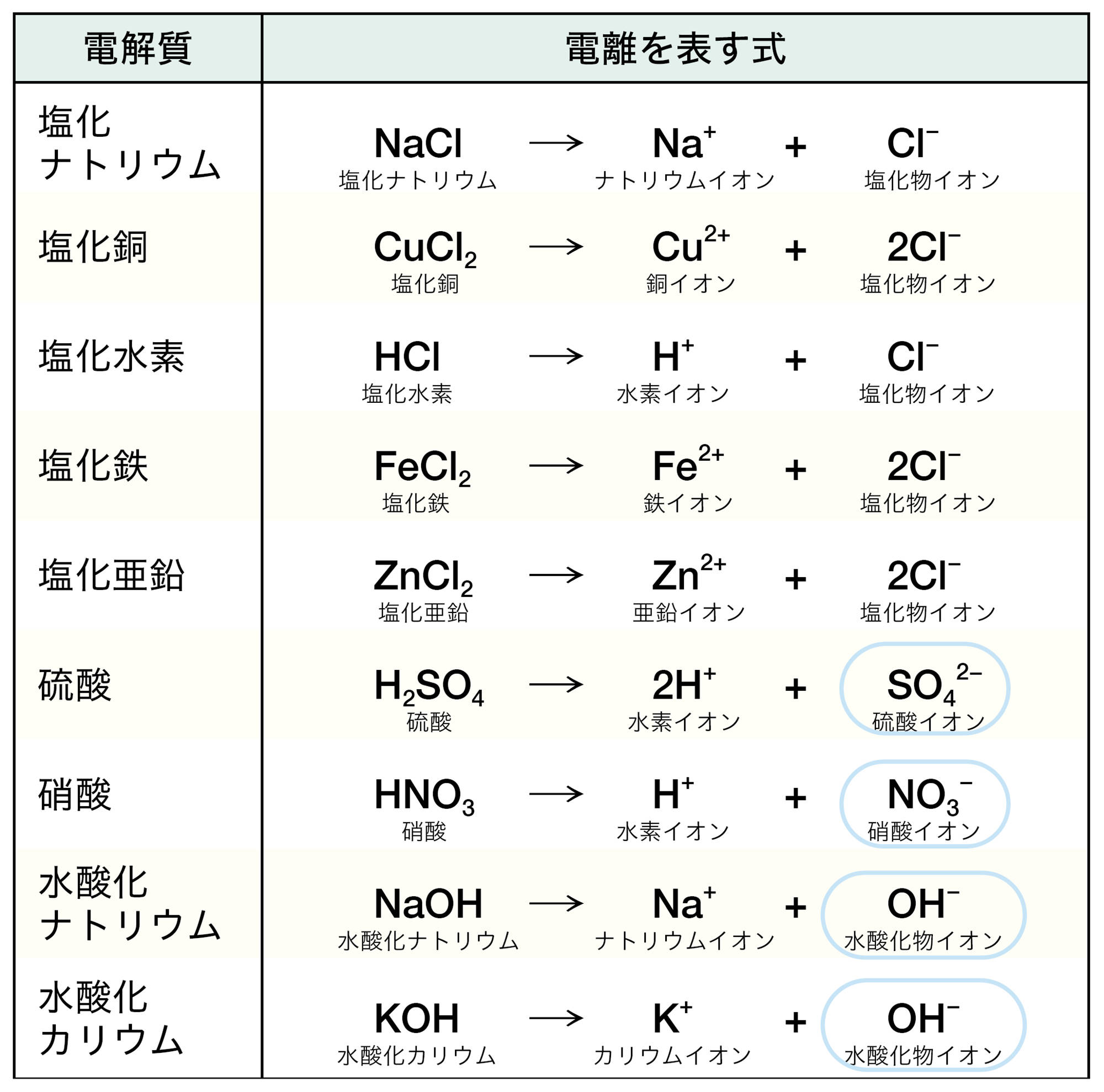
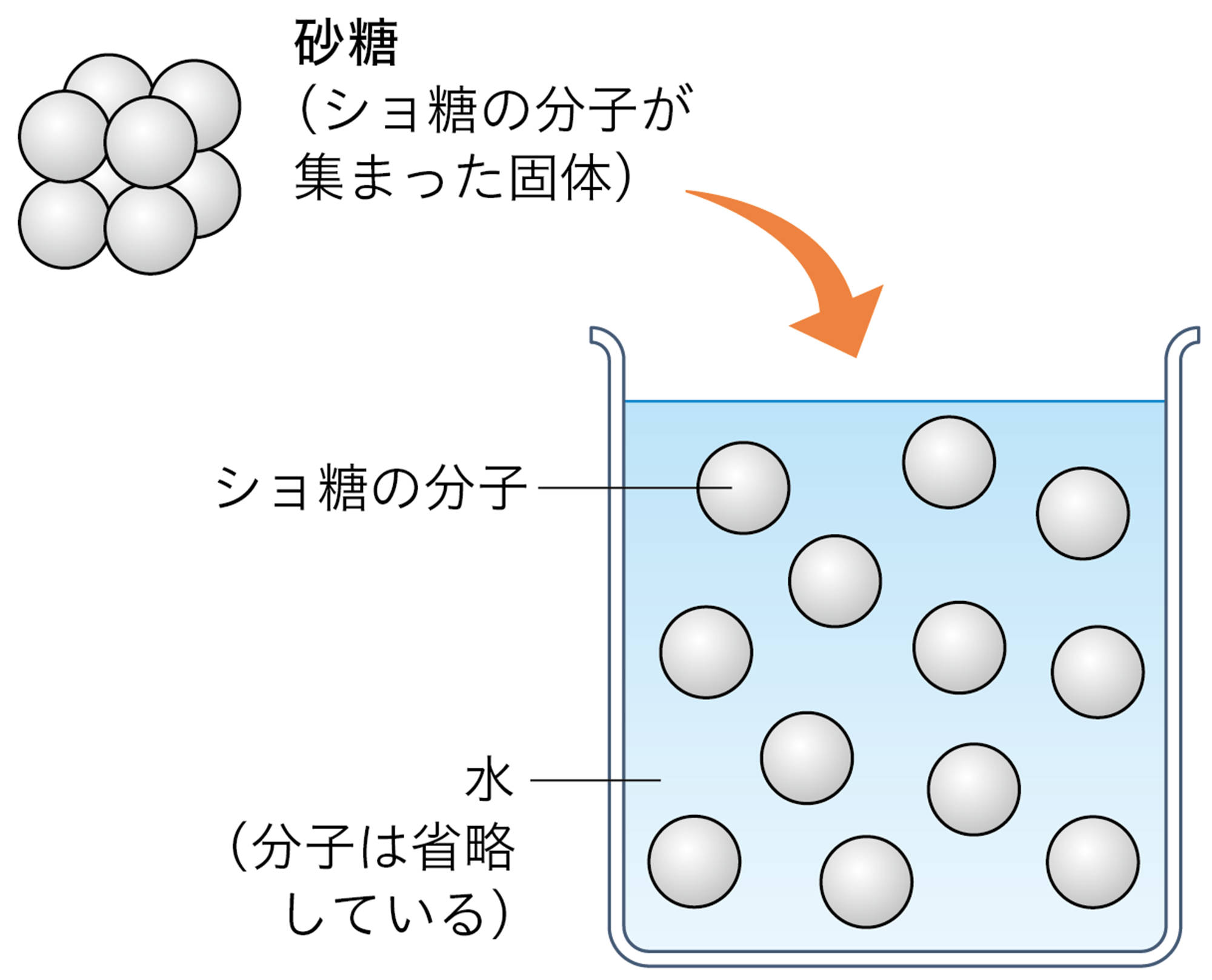
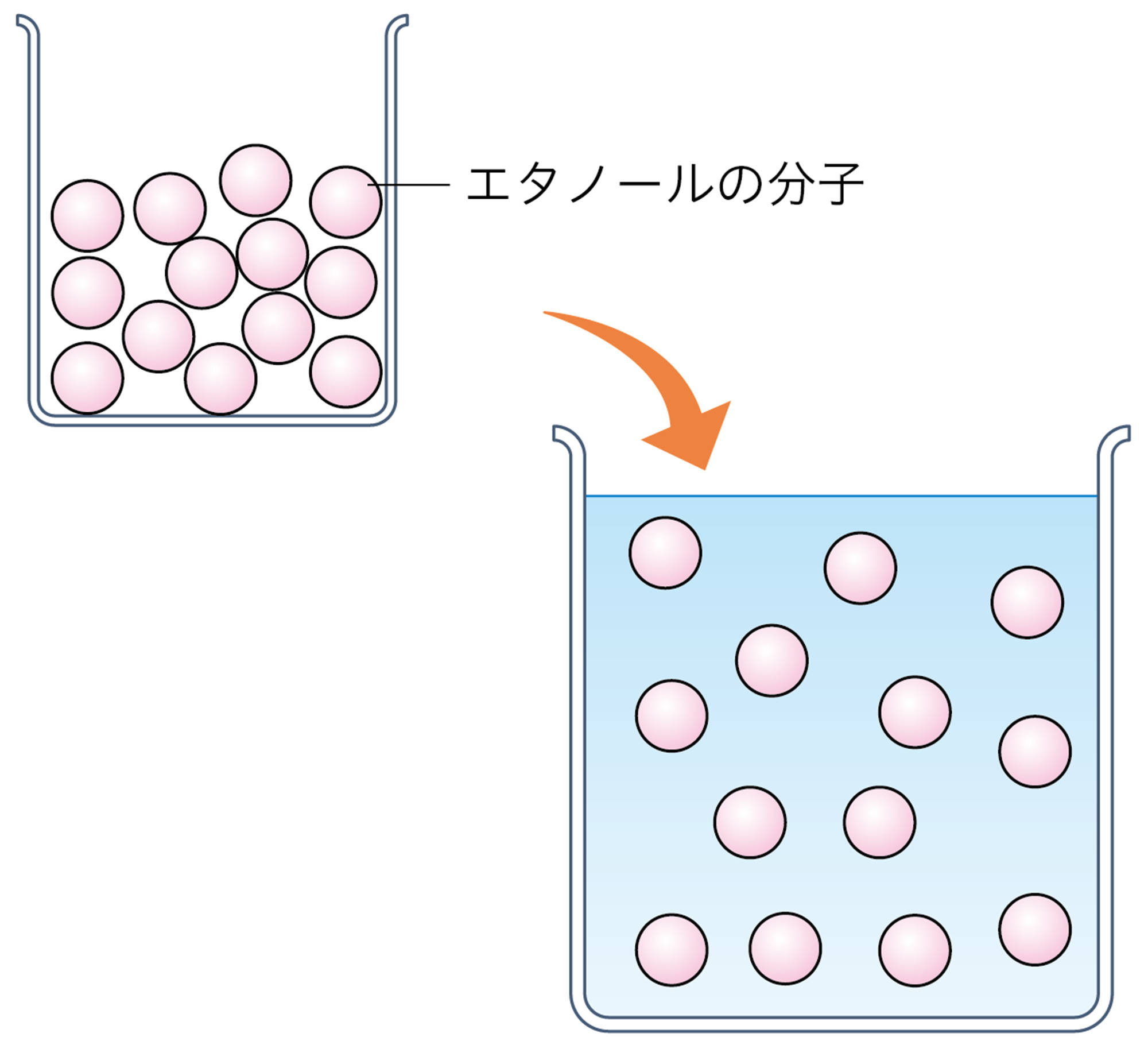
電解質は水に溶けたときにイオンが生じる物質で(表2),生じたイオンは,水溶液に電流を流す原因になる。エタノールや砂糖などの非電解質は,水に溶けてもイオンが生じないため,水溶液は電流を流さない(図14)。

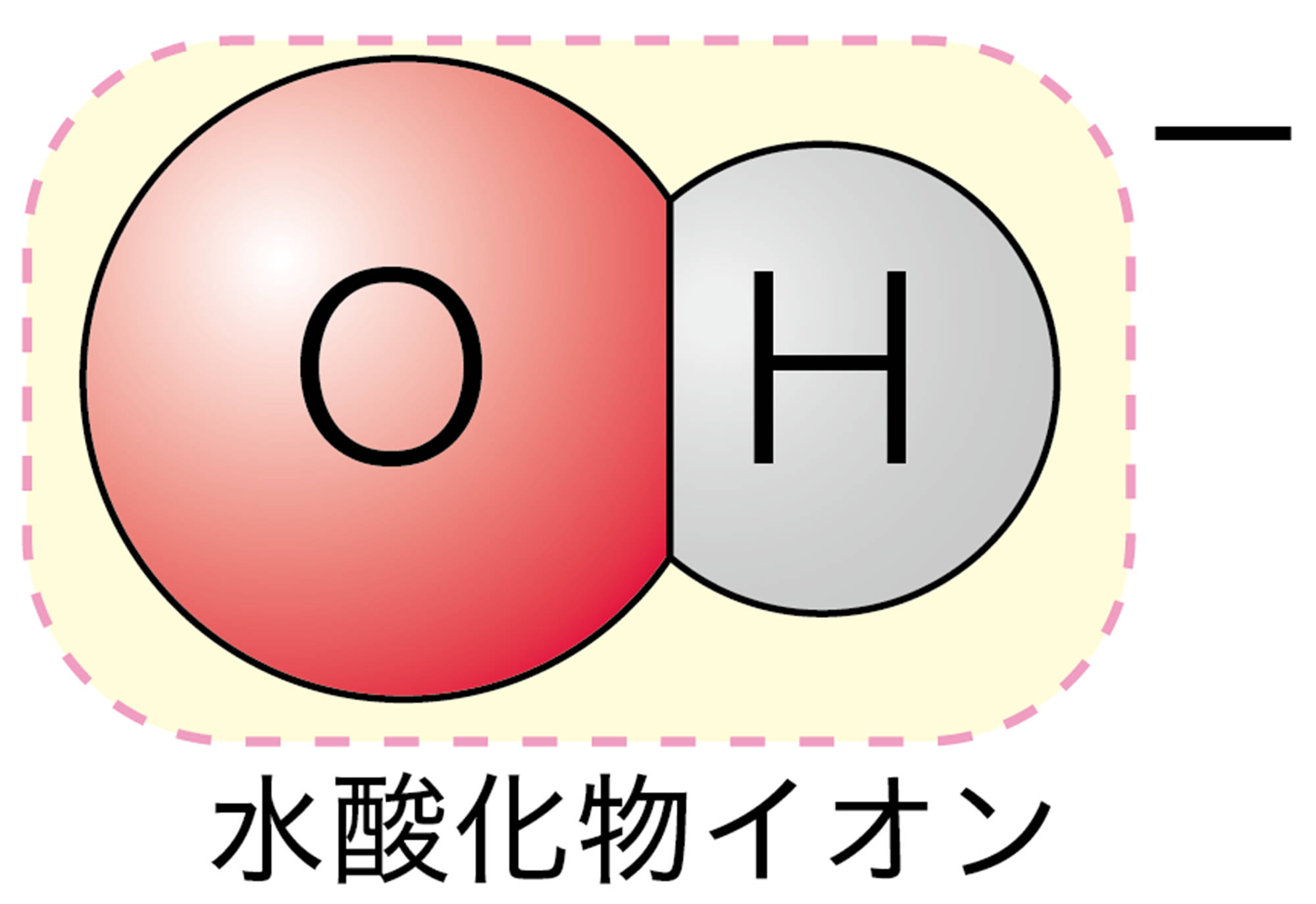
Clが塩素原子を表すのに,Cl⁻は「塩素イオン」ではないんだね。Hが水素原子で,H⁺は「水素イオン」なのに。

1個の原子がイオンになるときには,その呼び方は次のように表すことになっています。
・ 陰イオンは,語尾を変えて「~化物イオン」をつける。
この決まりにしたがうと,陽イオンであるH⁺ は「“水素”イオン」で,陰イオンであるCl⁻は「“塩”化物イオン」になりますよね。陰イオンには,ほかにフッ素原子F が1個の電子を受け取ってできるフッ化物イオンF⁻などがあります。なお,2個以上の原子の集まりからなるイオンには,それぞれ固有の呼び方があります。