gkt-horizontal-line
※このウェブページは中学校理科3年の学習内容です。<3年p.140>
仮説

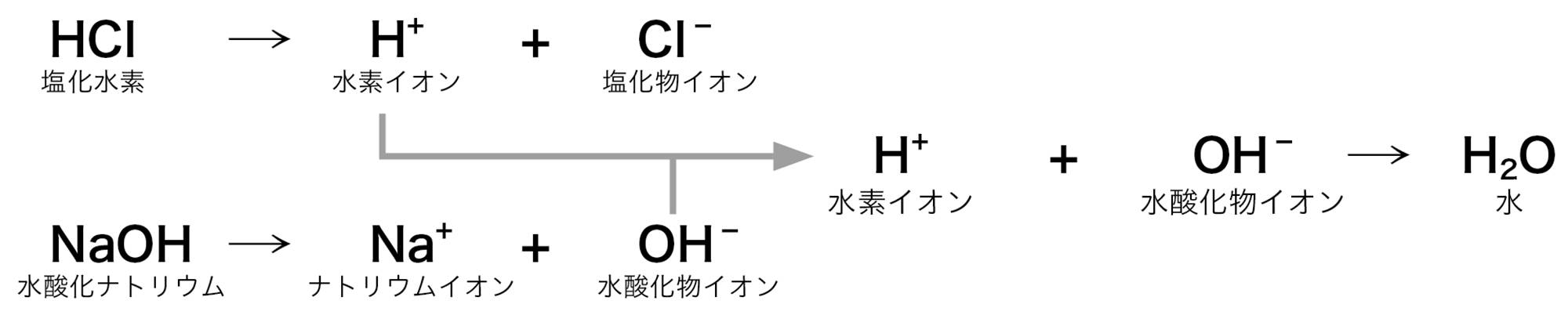
電離のようすから,仮説を下のように考えました。
水溶液中から,酸性の正体である水素イオンも,アルカリ性の正体である水酸化物イオンもなくなっていくので,水溶液が中性になっていくと思います。

水溶液中でイオンのままの粒子もあるはずです。

計画

酸性がだんだん弱くなっていくようすは,pHによって変化する試薬を使えば確かめることができる。
水が増えたことは確認できないね。もともと水があるから。


ナトリウムイオン,塩化物イオンが増えたことは確かめられるかな。
方法
準備
塩酸(0.5%),水酸化ナトリウム水溶液(0.5%),BTB溶液,試験管(2),ビーカー(2),こまごめピペット,小さいスポイト,ガラス棒,スライドガラス,顕微鏡またはルーペ,ドライヤー(またはホットプレート),保護めがね
1.塩酸をとる
こまごめピペットで塩酸を4cm³とり,それぞれ試験管㋐,㋑に入れる。
試験管にBTB溶液を2〜3滴加える(水溶液は黄色になる)。

こまごめピペットの先を上に向けないように注意しましょう。ゴム球に液が入ってゴム球がいたんでしまいます。