gkt-horizontal-line
※このウェブページは中学校理科3年の学習内容です。<3年p.145>
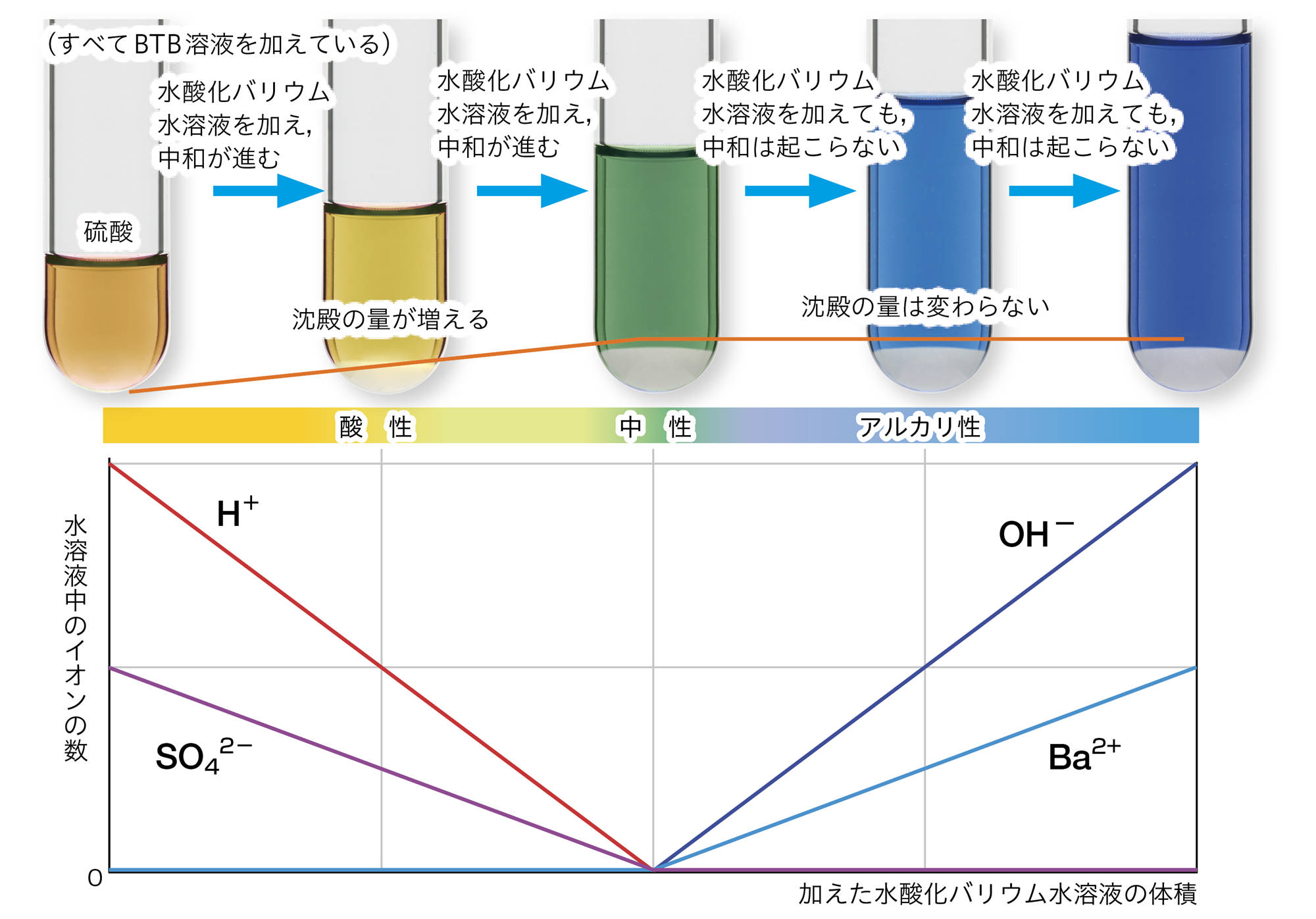
硫酸の化学式はH₂SO₄です。つまり電離により,2個のH⁺が生じるとき,1個のSO₄²⁻が生じます。水酸化バリウムの化学式はBa(OH)₂です。電離により,1個のBa²⁺が生じるとき,2個のOH⁻が生じます。

アルカリ性水溶液を加えていくと,中和が起こってH⁺の数が減少していき,中性を通り過ぎると中和が起こらないので,加えたぶんだけOH⁻の数が増加していきます。中性を通り過ぎると,新たな沈殿も生じなくなります。