gkt-horizontal-line
※このウェブページは中学校理科3年の学習内容です。<3年p.262>
発展 塩化銅水溶液の電気分解のとき,陽極でなぜCl₂が発生するか
塩化銅水溶液の電気分解(p.121)で,水溶液中のCl⁻が陽極でCl₂になるとき,電子の性質が関わっている。
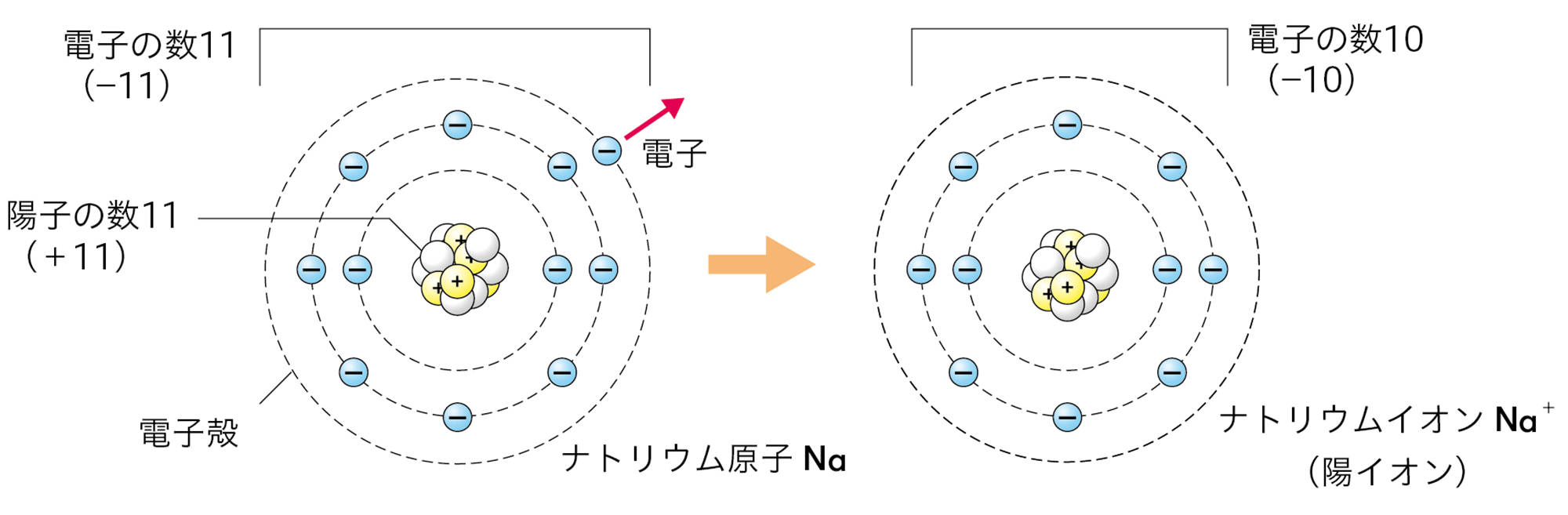
●電子殻
原子を構成している電子は,原子核を中心とするいくつかの層に分かれて存在している。この層を「電子殻」といい,各電子殻に入ることができる電子の数は決まっている。
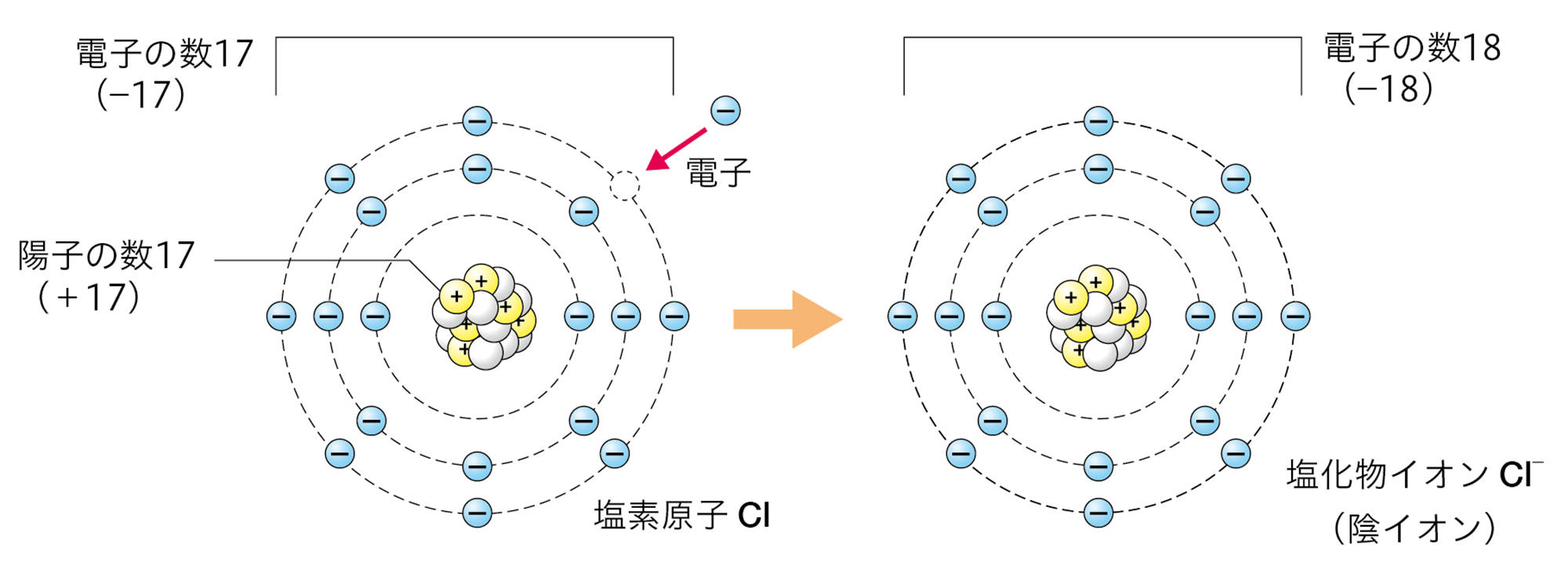
たとえば,ナトリウム原子Naの最も外側の電子殻には電子が1個しかないので,この電子を放出してNa⁺になりやすい。塩素原子Clの最も外側の電子殻には電子が7個あるが,ここには電子は8個まで入れるので,電子を1個受け取ってCl⁻になりやすい。
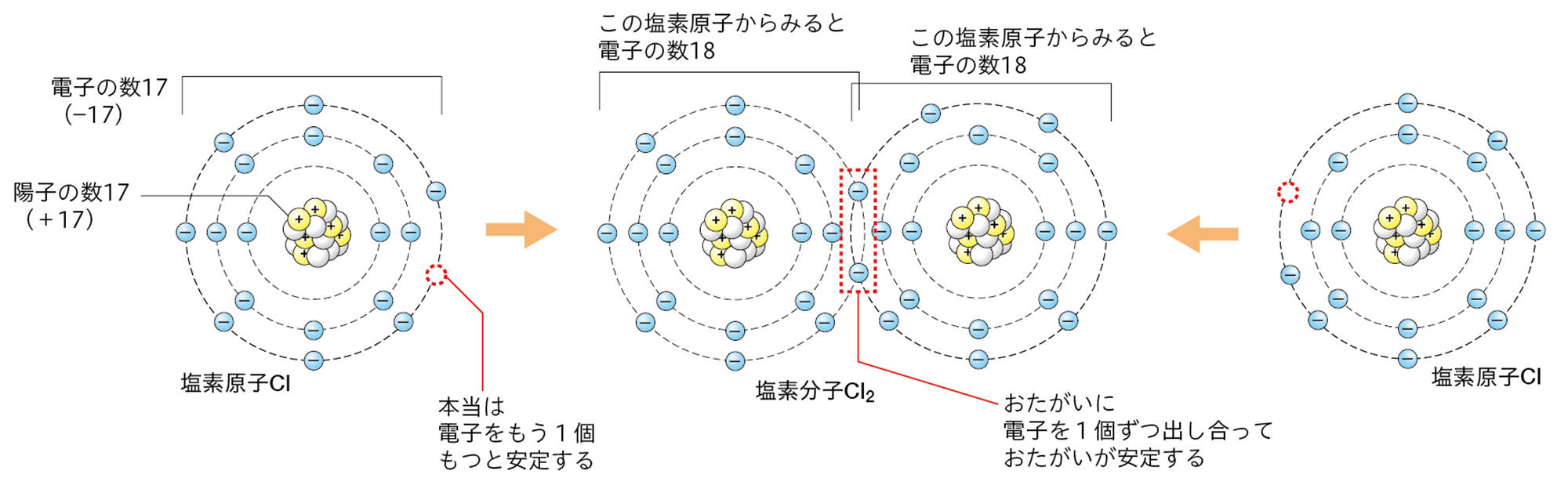
●Cl₂分子のできかた
塩化銅水溶液を電気分解すると,水溶液中のCl⁻は陽極で電子を1個放出して,塩素原子Clになる。
塩素原子は,最も外側の電子殻に7個の電子をもち,電子が8個のときに安定する。このような状態の塩素原子が2個あったとき,2個の塩素原子が1つずつ電子を共有して,安定した1個の塩素分子Cl₂になる。
つまり,塩化銅水溶液の電気分解のとき,陽極で塩化物イオンが塩素原子の状態になると,そのままでは安定ではなく,塩素原子2個が結びついてしまったほうが安定する。これが,陽極でCl₂が発生する理由である。
原子には,いくつかの原子が電子を共有して結びつくことで安定する性質がある。電子を共有して原子どうしが結びついたまとまりが,分子である。