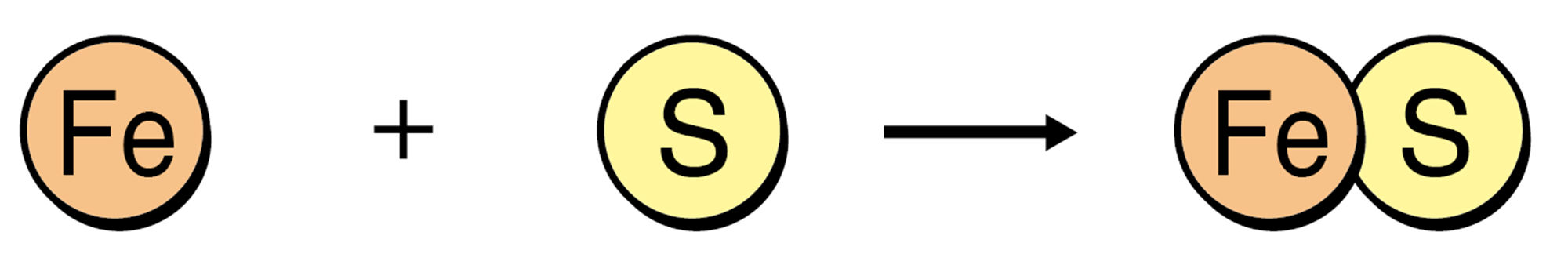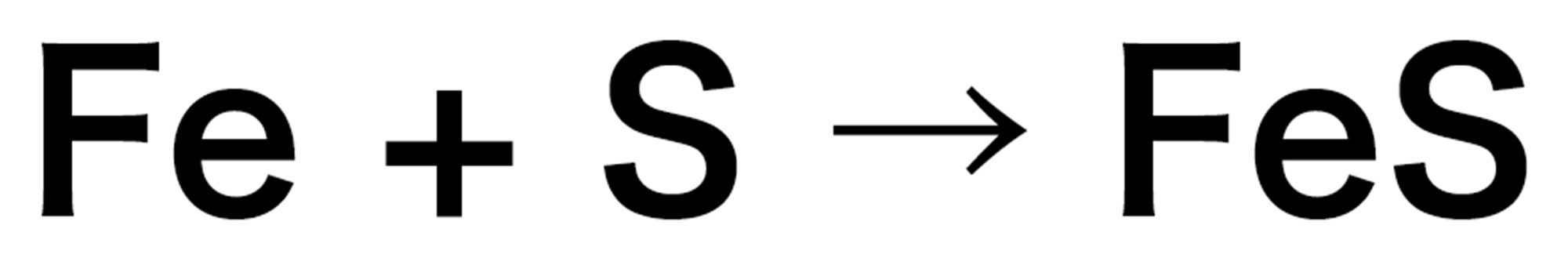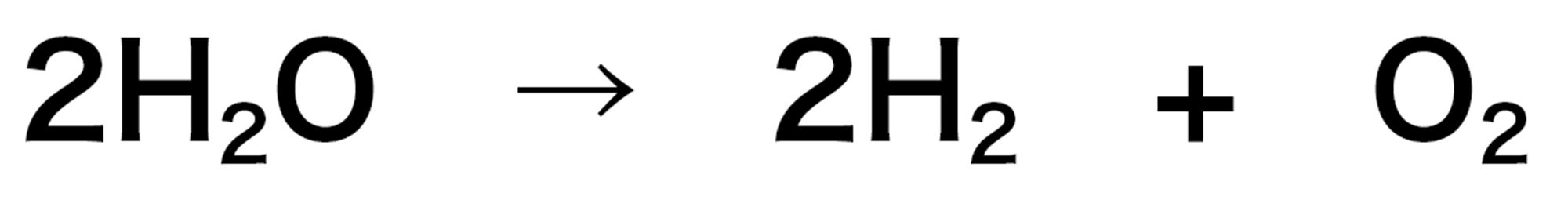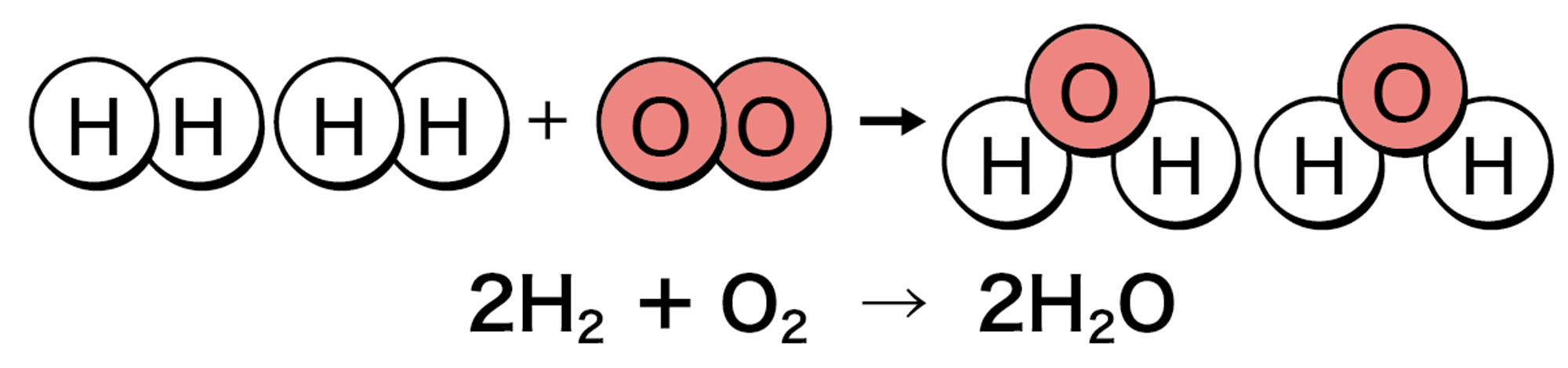※このウェブページは中学校理科2年の学習内容です。<2年p.38>
1|化学反応式
1 化学変化の前後における物質の質量
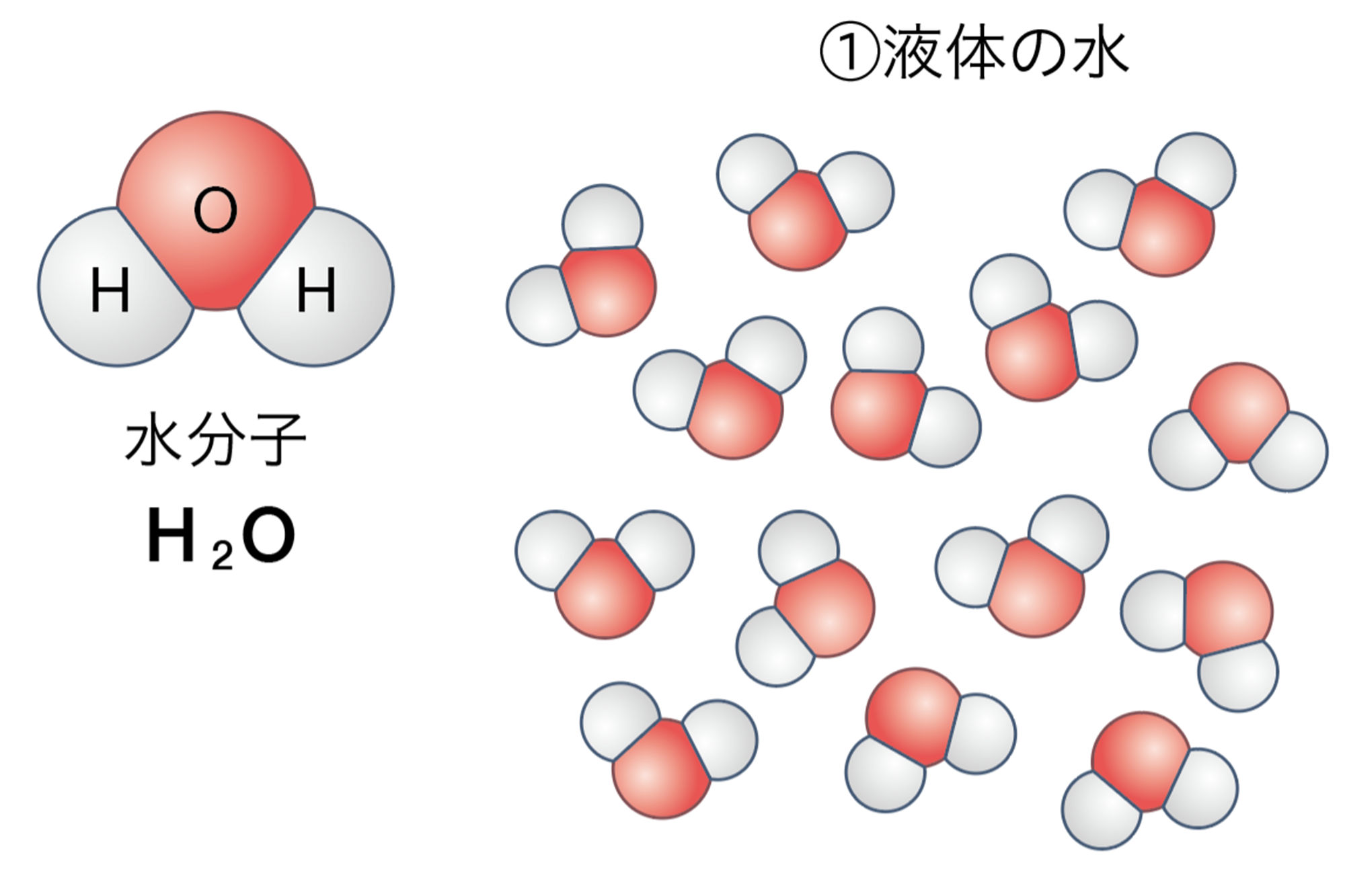
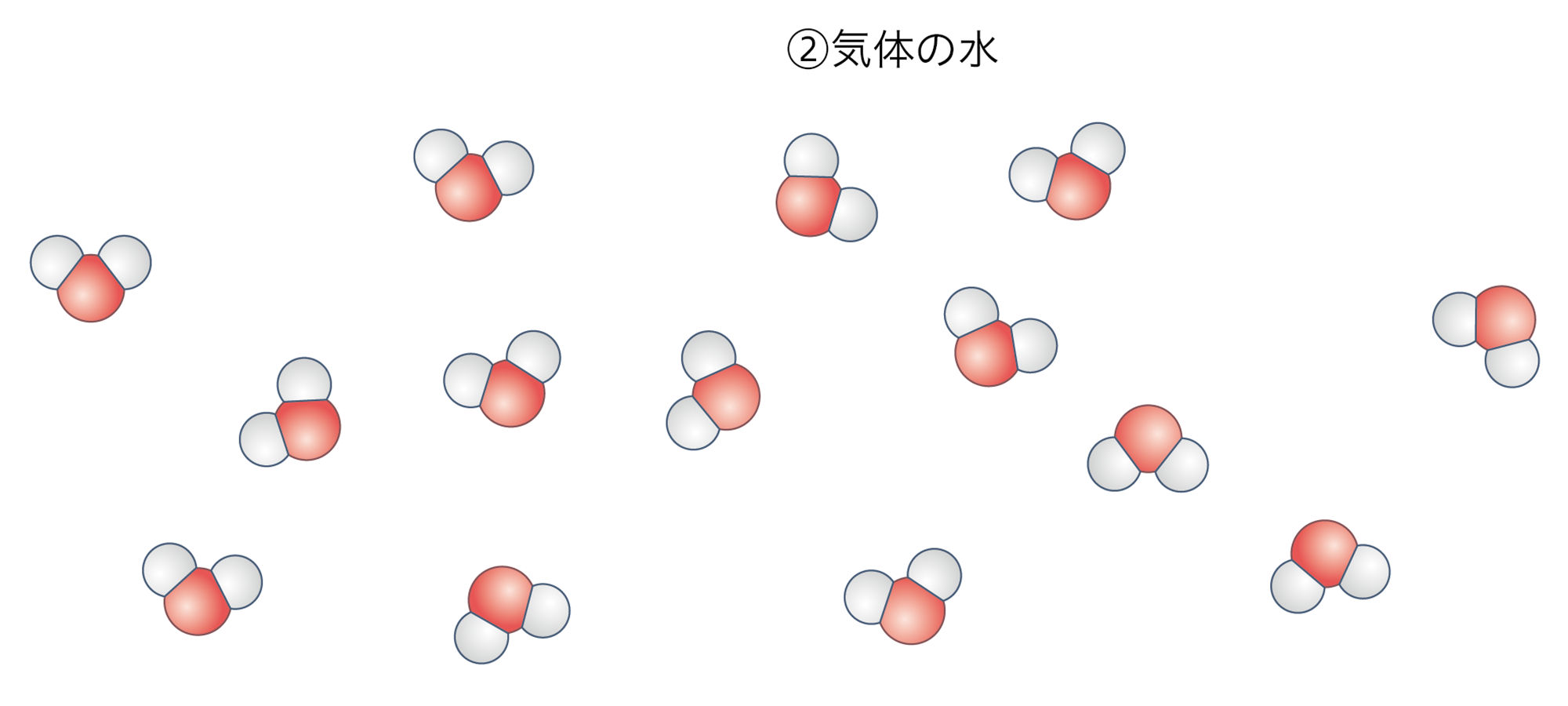
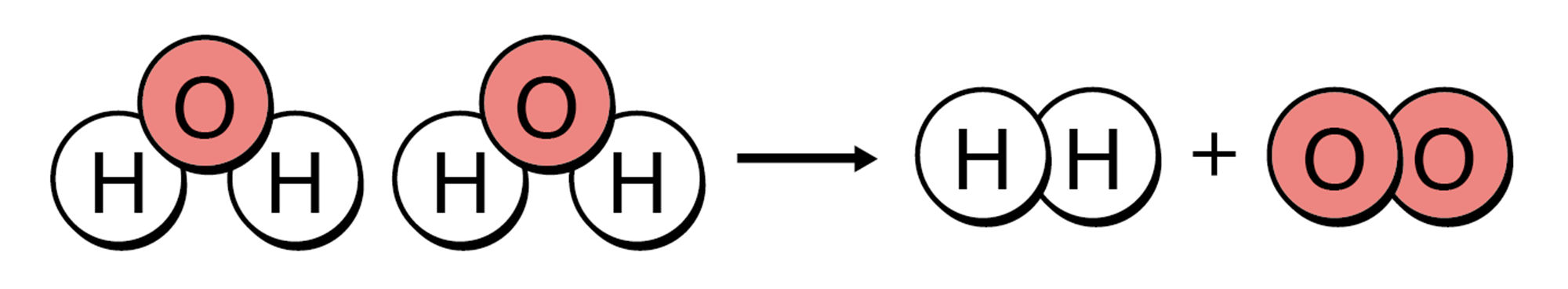
中学校1学年では,物質が固体,液体,気体と状態変化したとき,体積は変わるが質量は変わらないことを学んだ。これを原子のモデルで考えると,液体の水が蒸発して気体の水(水蒸気)になったとき,分子どうしの距離が広がるが,水分子そのものは変化せず,水分子の数も変化しないと説明できる。
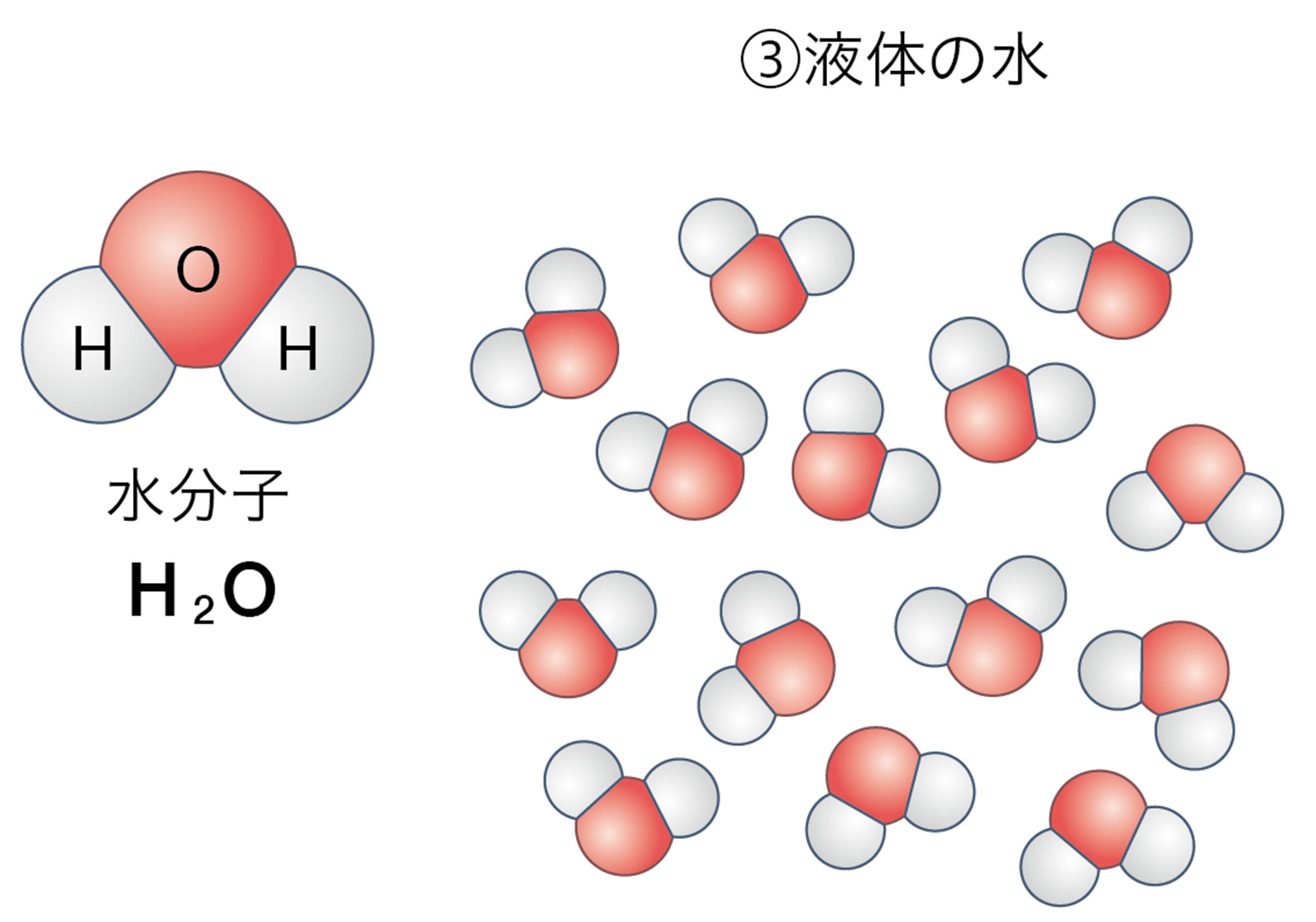
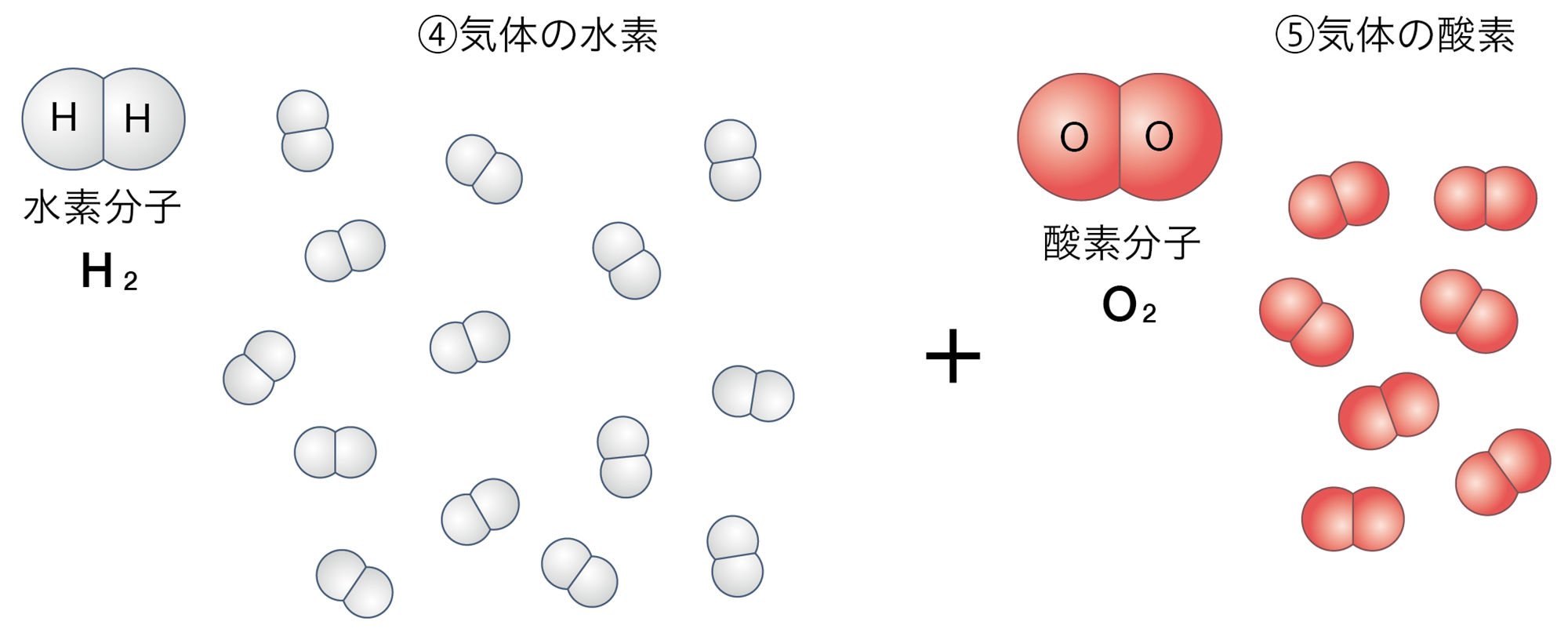
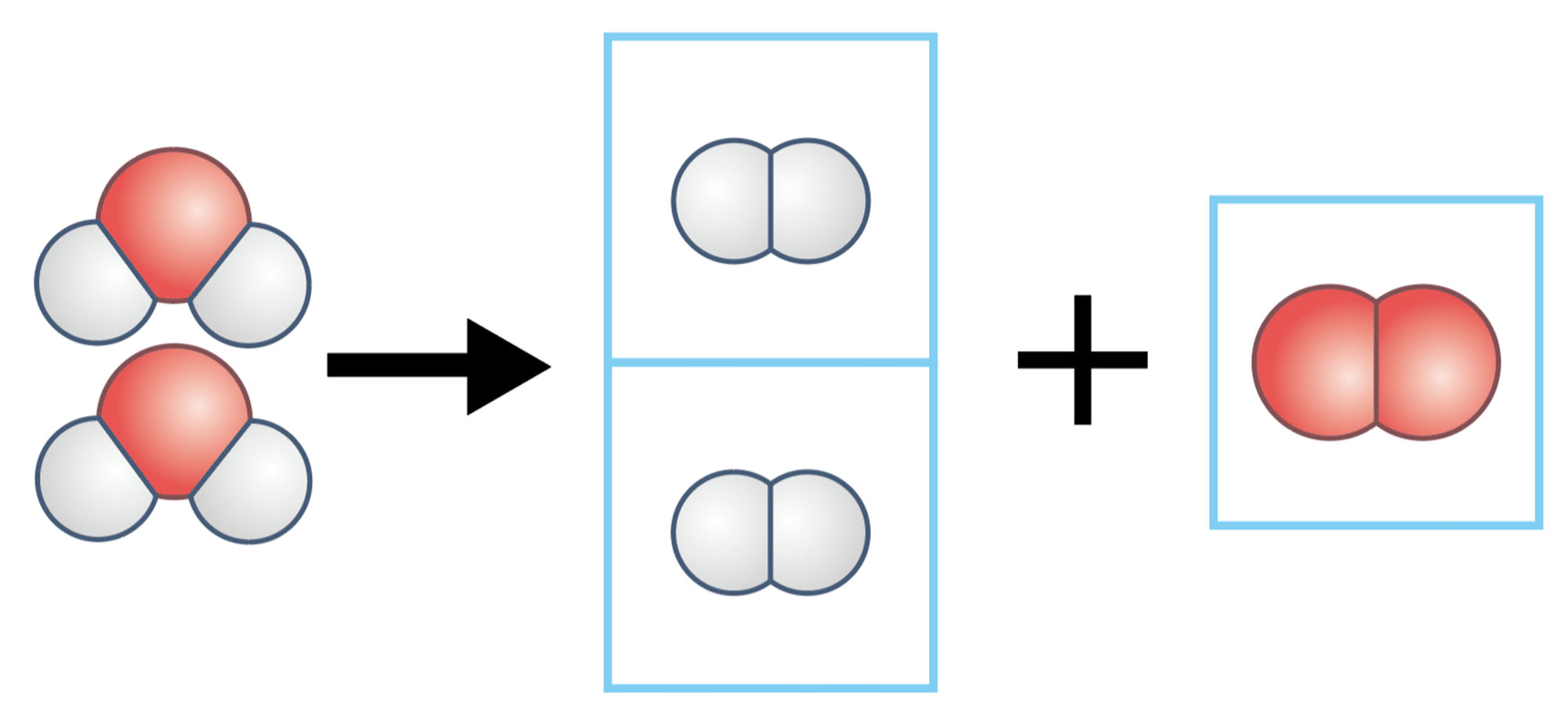
一方,探究3では,水分子そのものがばらばらになり,水素分子と酸素分子に分かれたといえる。このときの化学変化の前後の質量について考えてみよう。
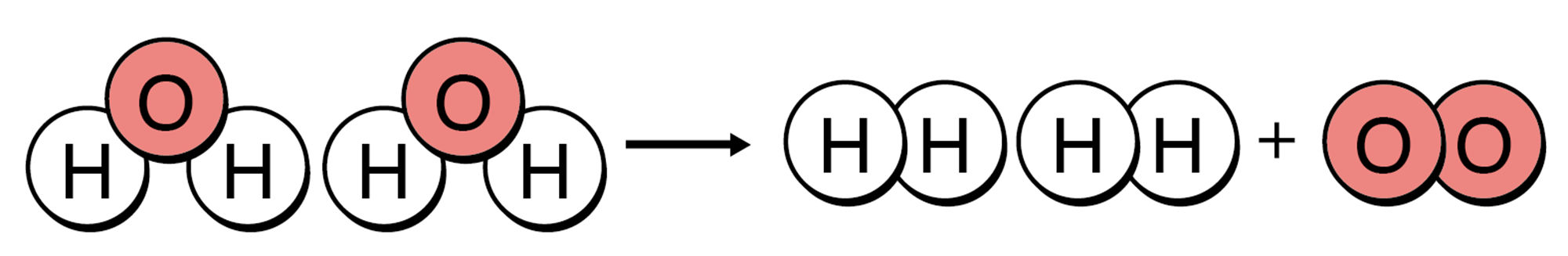
図1の①から②に変化したとき,③から④⑤と変化したとき,前後で原子の数が変わらないことに注意しましょう。

図1 水の状態変化と分解
図2 気体が発生する化学変化

二酸化炭素や水素を発生させる実験も化学変化を利用していたんだね。
このとき,「発生させる前からあった物質」「発生した物質」「残った物質」の質量には関係があるのかな。

※このウェブページは中学校理科2年の学習内容です。<2年p.39>
物質が原子でできていると考えたとき,2種類の異なる物質による化学変化と質量の関係は,どのように科学的に探究できるだろうか。
探究5 化学変化と質量

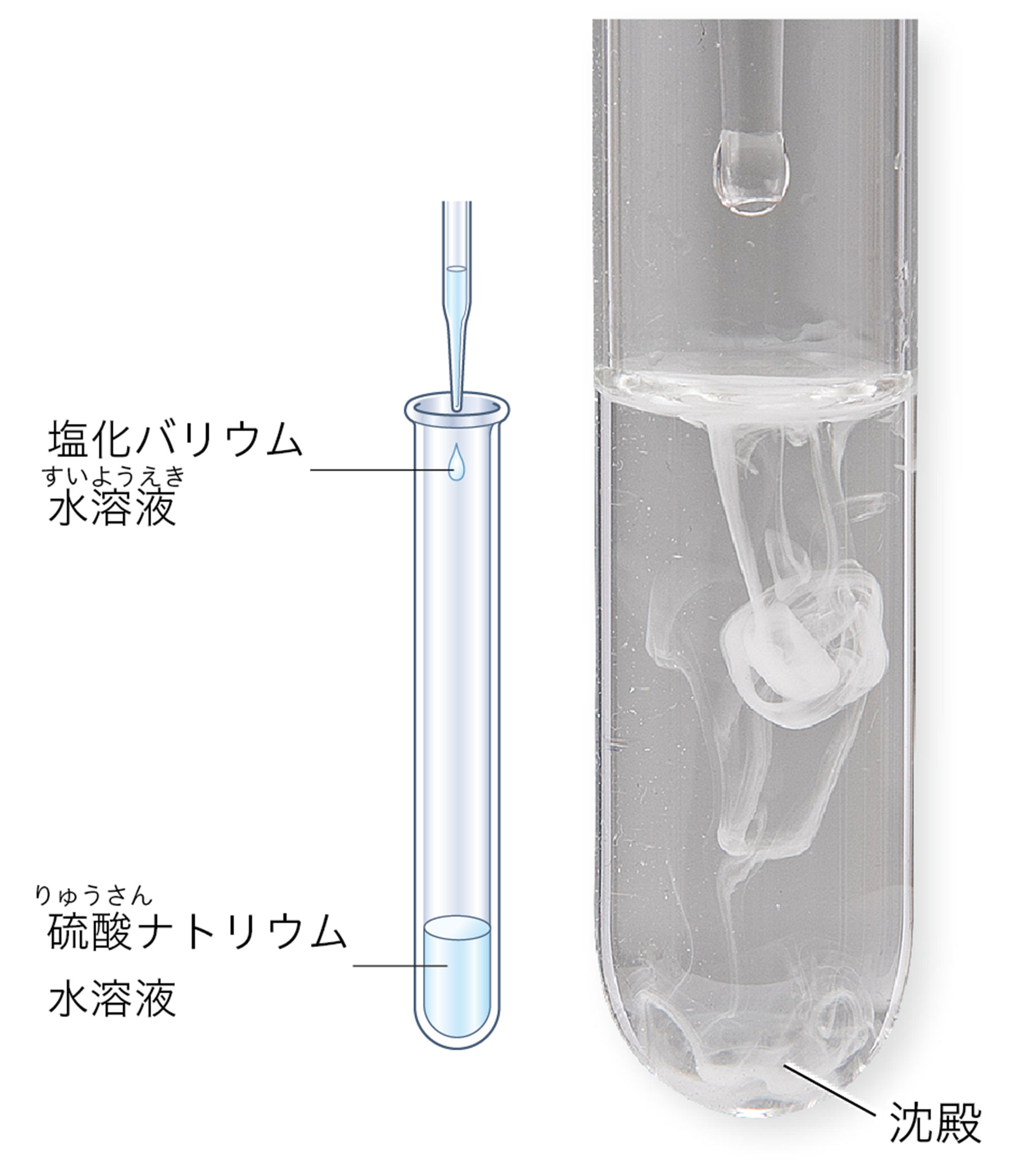
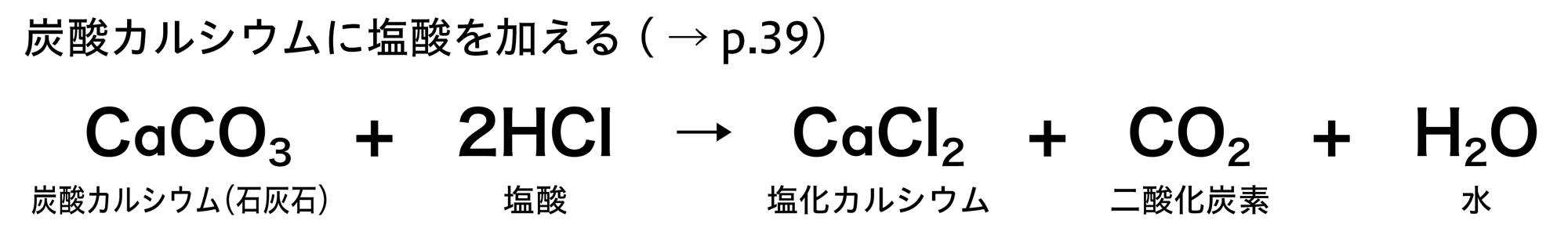
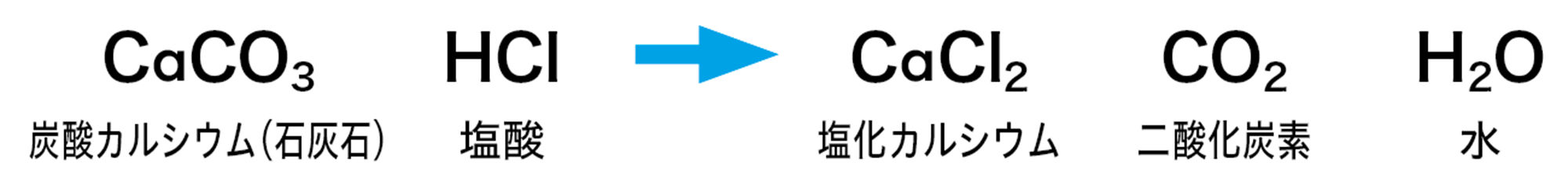
図3の化学変化は「沈殿」ができます。沈殿とは,水に溶けないで容器の底に沈んでたまった固体です。図4の化学変化は,気体が発生します。
化学変化の前後における物質全体の質量はどのように変化するか。原子の性質から仮説を立て,実験で確かめる。

沈殿ができたということは,その分質量が増えたのかな?
化学変化に関わる物質はこうなります。



化学変化の前後で物質が変化するから,質量をもらさず測定しなければいけないね。図4の化学変化は,発生した気体がにげてしまっている。
ふたをして気体をとどめておけないかな。


実験前と実験後で,容器ごと測定すると比較しやすいね。
※このウェブページは中学校理科2年の学習内容です。<2年p.40>
実験A 沈殿ができる化学変化
準備
硫酸ナトリウム水溶液(5%),塩化バリウム水溶液(5%),カップ(2),電子てんびん,保護めがね
実験前後での質量をはかる
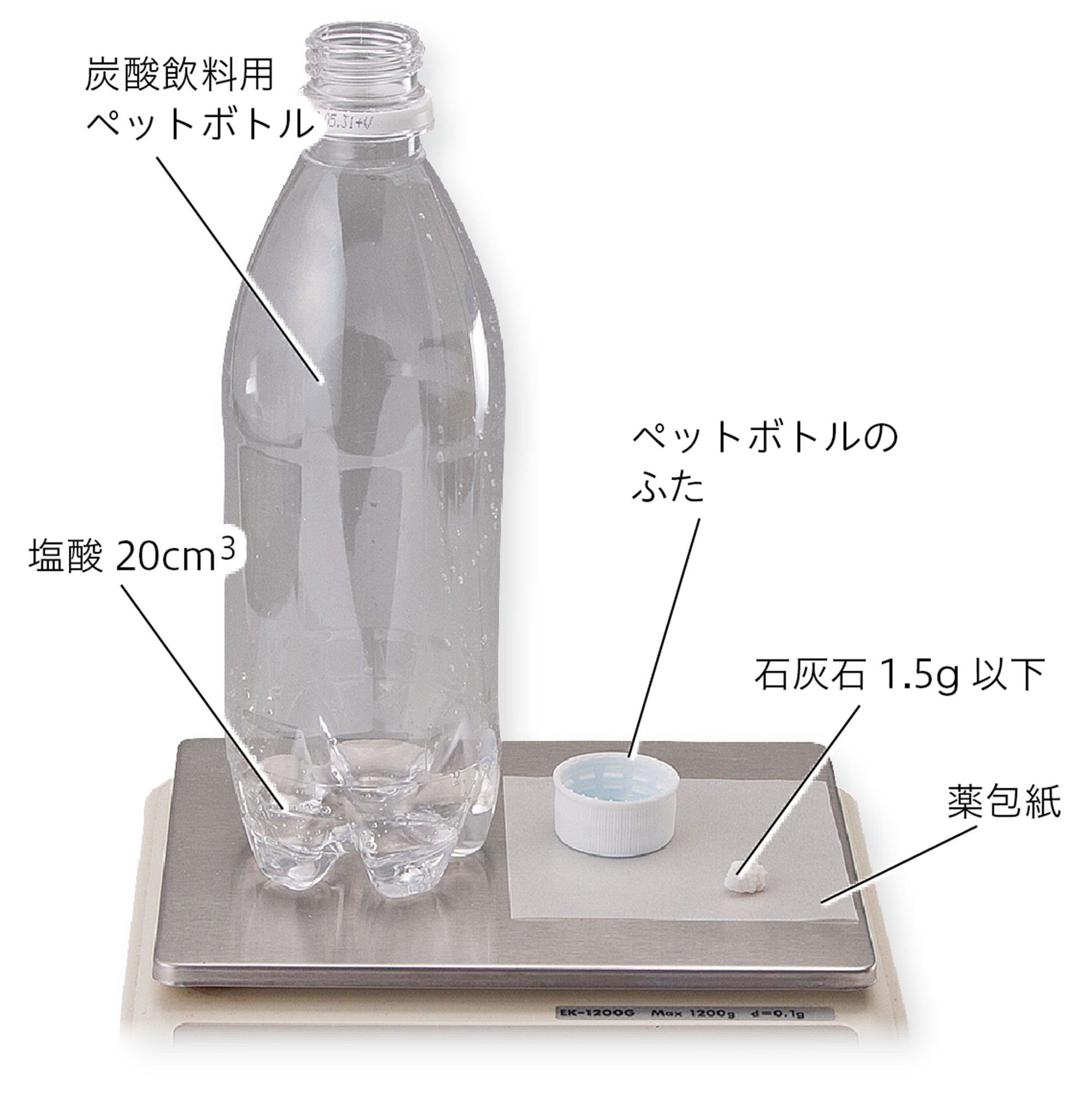
実験B 気体が発生する化学変化
準備
塩酸(5%),石灰石(1.5g以下),ペットボトル(炭酸飲料用,500cm³),薬包紙,電子てんびん,保護めがね
実験前後での質量をはかる
注意!!
石灰石を入れたら,ふたがよくしまっていることを確認する。
ふたをあけるときは,ゆっくりゆるめる。ペットボトルの中から強い力がはたらいていて,ふたが飛んでしまうことがある。
※このウェブページは中学校理科2年の学習内容です。<2年p.43>
2 質量保存の法則
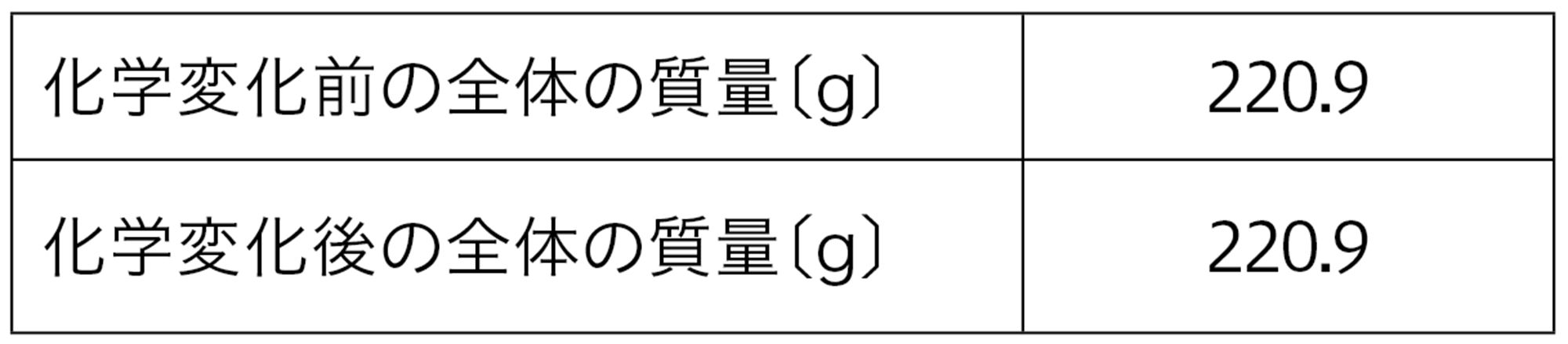
探究5の結果,沈殿ができる化学変化でも,気体が発生する化学変化でも,化学変化の前後で質量が変化しないことがわかる。これを【質量保存の法則】という。
3 化学反応式
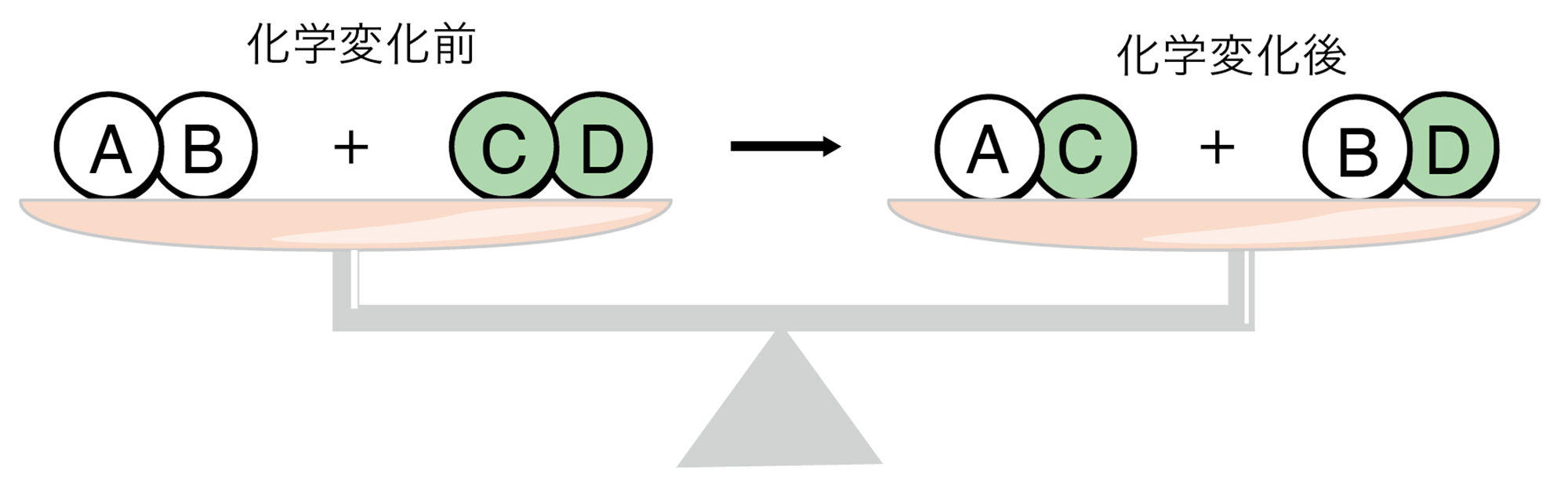
原子の性質( → p.16 図6)や質量保存の法則から,化学変化の前後では,原子がなくなったり,新しくできたりするのではなく,原子が結びつく組み合わせが変わっているだけだと考えることができる(図5)。
原子はなくなったり,新しくできたりしないのだから,質量保存の法則は当たり前のように思えます。しかし,原子の考えがまだない時代にはそうではありませんでした。p.41「理路整然」で示したように,質量を精密に調べる実験の積み重ねによって得られた法則です。

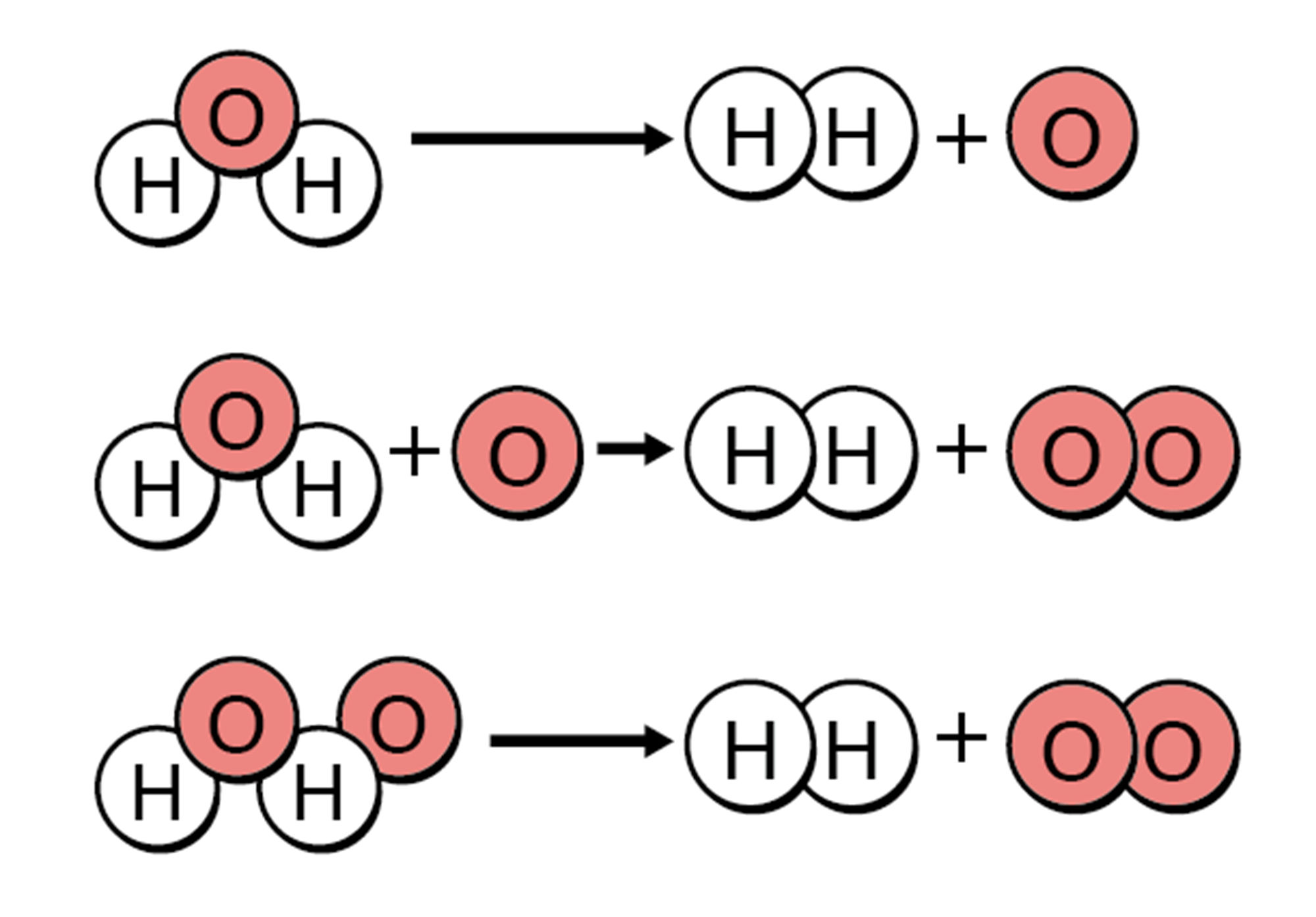
物質が結びついたり,分解したりするような化学変化について,化学式を用いて表した式を【化学反応式】という。化学反応式では,原子の種類と数が化学変化の前後で合うようにする。

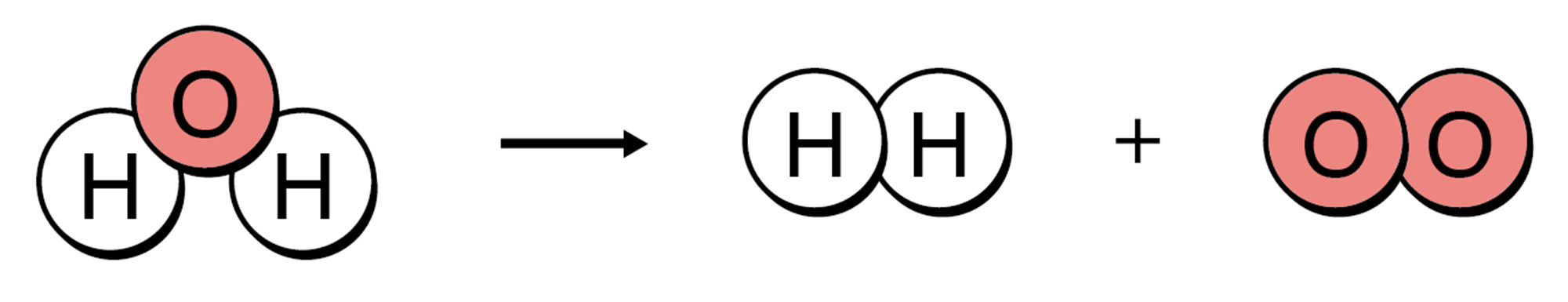
同じようにして,水の電気分解を表してみました。あれ?右側の酸素原子の数が増えました…
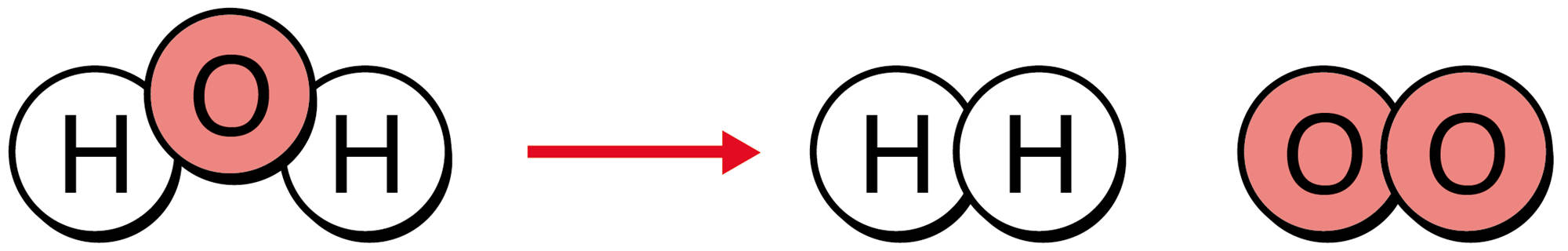
もし,→の左右の原子の数が合わなければ,「原子が,化学変化でほかの原子に変わったり,なくなったり,新しくできたりした」ことになってしまいますね。つまりその化学反応式は直す必要があります。(次ページ)

※このウェブページは中学校理科2年の学習内容です。<2年p.44>
<水の電気分解の化学反応式>
● 化学反応式では,⇒の左側に変化前の物質を,右側に変化後の物質を書く。
● 化学反応式の左側と右側では,原子の種類や数は同じでなければならない。
化学反応式が表していること
① 化学変化前の物質と,化学変化後の物質がわかる。
② 化学変化前の物質と,化学変化後の物質の分子や原子の数の関係がわかる。
図6 化学反応式を書くときの決まり
※このウェブページは中学校理科2年の学習内容です。<2年p.45>
4 化学反応式と質量
化学反応式と質量の関係について,探究6を行い,より細かく調べていこう。酸化がかかわる化学変化の前後での質量について,原子の性質から,どのように科学的に探究できるだろうか。
探究6 酸化物の質量

化学変化と質量の関係をさらにくわしく調べましょう。図7のように銅粉(銅の粉末)を加熱して,化学変化の前後で質量をはかります。銅が酸化されてできる酸化銅の化学式はCuOです。
金属を加熱したとき,化学変化の前後の物質の質量にはどのような関係があるか。化学反応式から考える。

Cu原子にも,O原子にも質量があるんだよね。その結びつき方から質量に対する仮説が立てられないかな?
酸化銅の化学式がCuOだということは,銅原子と酸素原子は1:1で結びついているという意味だね。


実験方法は探究1が参考になるね。まず金属の粉末をはかり取って,それを加熱したあと質量をはかろう。
わずかな質量の変化を知りたいから,銅の粉末がこぼれないように注意しないと結果が正確でなくなってしまう。

※このウェブページは中学校理科2年の学習内容です。<2年p.243>
基本操作 誤差を意識する
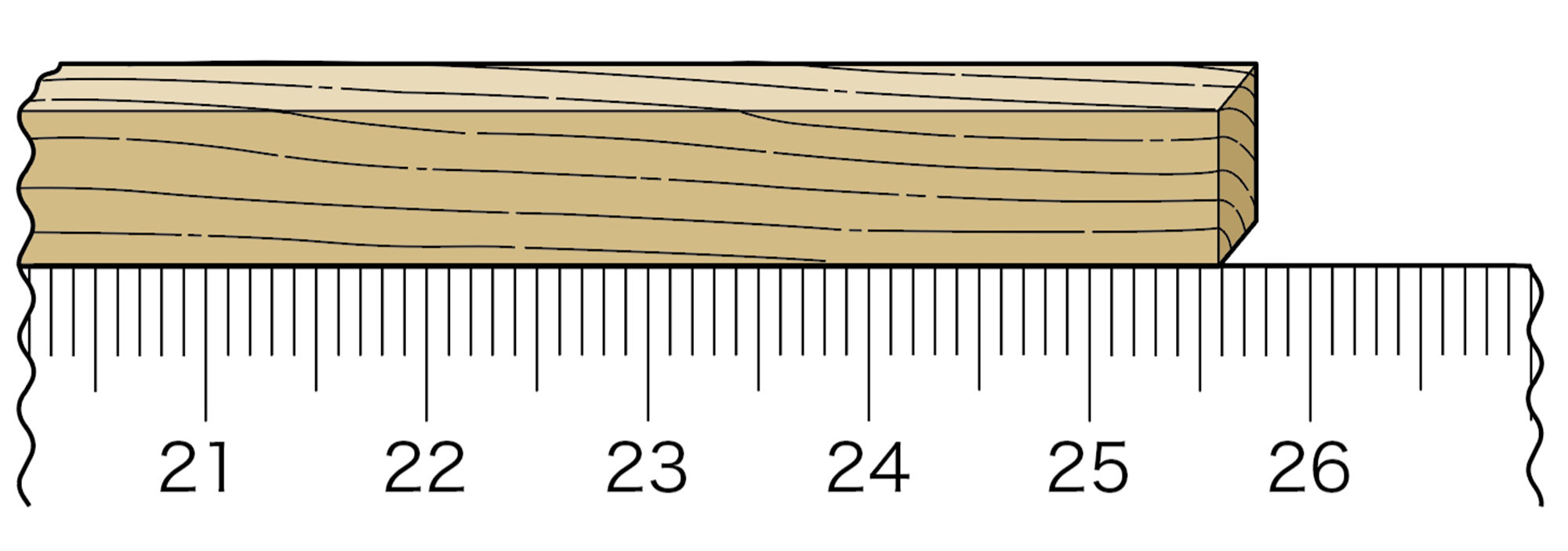
私たちは,ものさしで物体の長さをはかったり,てんびんで物体の質量をはかったりします。実はこのとき,本当の値ははかることができません。測定器の精度や,人による計器の読み取りの精度など,いろいろな原因によって,測定値には不正確さが入ってきます。測定値と真の値の差を誤差といいます。
理科では,目盛りの読み方として「最小目盛りの1/10まで数値を読み取る」と決めています。たとえば1 mm目盛りのものさしで,図のように木材の長さをはかり,255.8 mmという測定値を得たとしましょう。255.8という測定値は,ものさしの目盛りを読み取って得た有意義な数字ですから,これを有効数字といいます。この場合,有効数字は4桁であるといい,最後の8という数字には,目分量で読み取ったため,誤差がふくまれることになります。
有効数字は桁数で表現します。たとえば,ある棒の長さをcmの単位まではかり,350 cmという測定値を得たとします。この測定値をm単位で表し,かつ有効数字が3桁であることを示したいときは,3.50 mと書きます。
※このウェブページは中学校理科2年の学習内容です。<2年p.46>

化学反応式で考えるとこういうことだね。
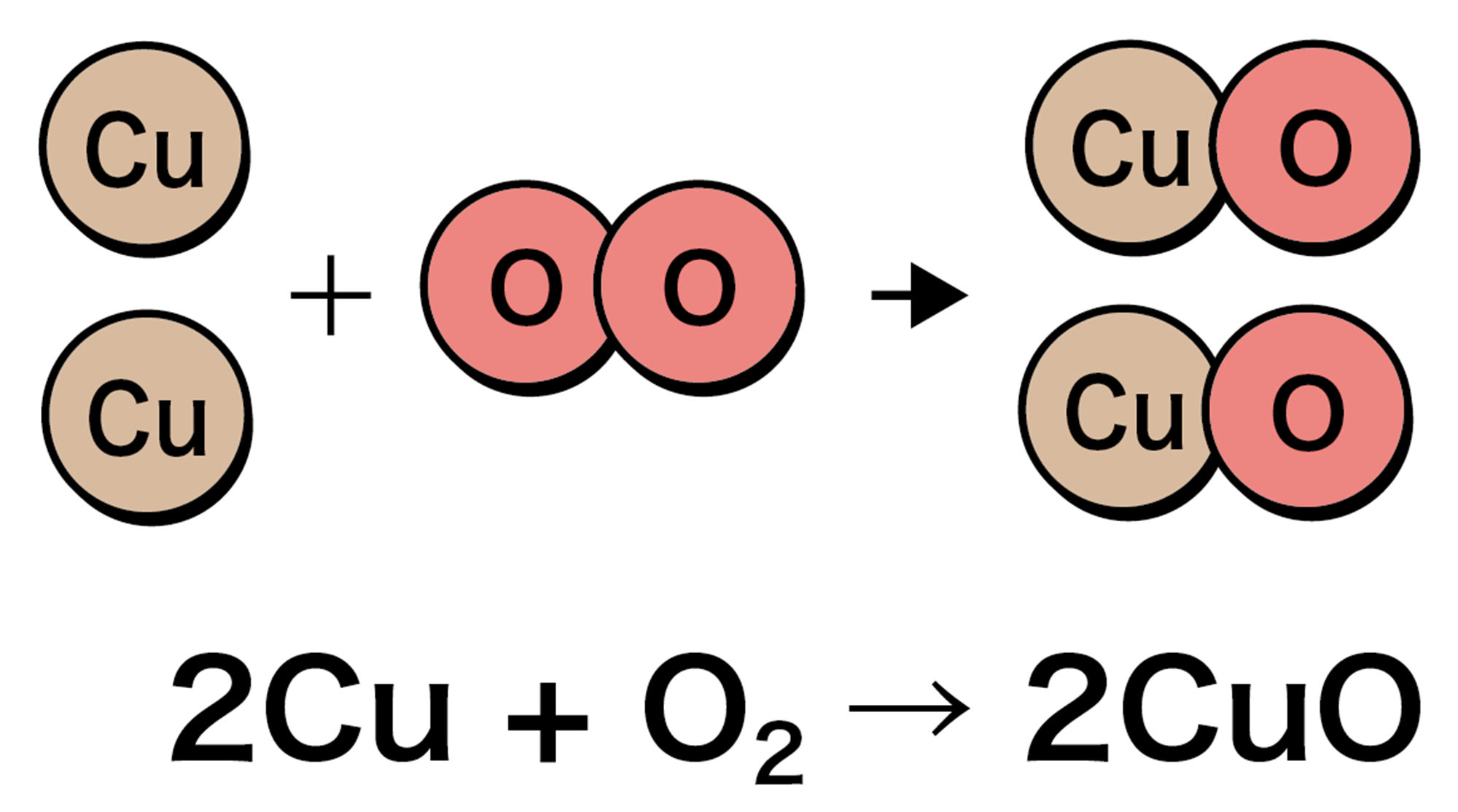
マグネシウムの場合は,このように考えることができるね。
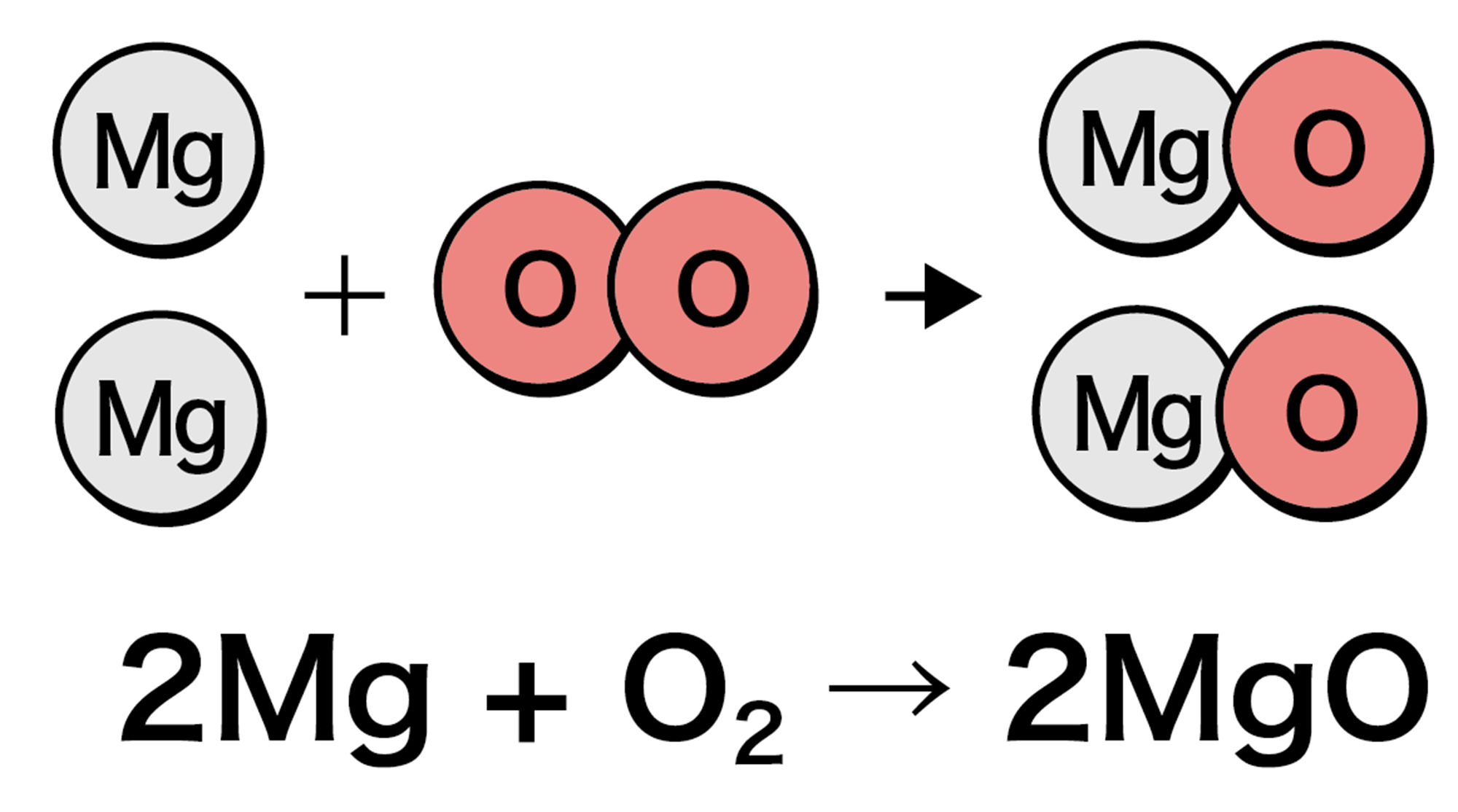


化学式から考えると,酸化銅ができるとき,酸素がたくさん結びつくわけではなさそう。
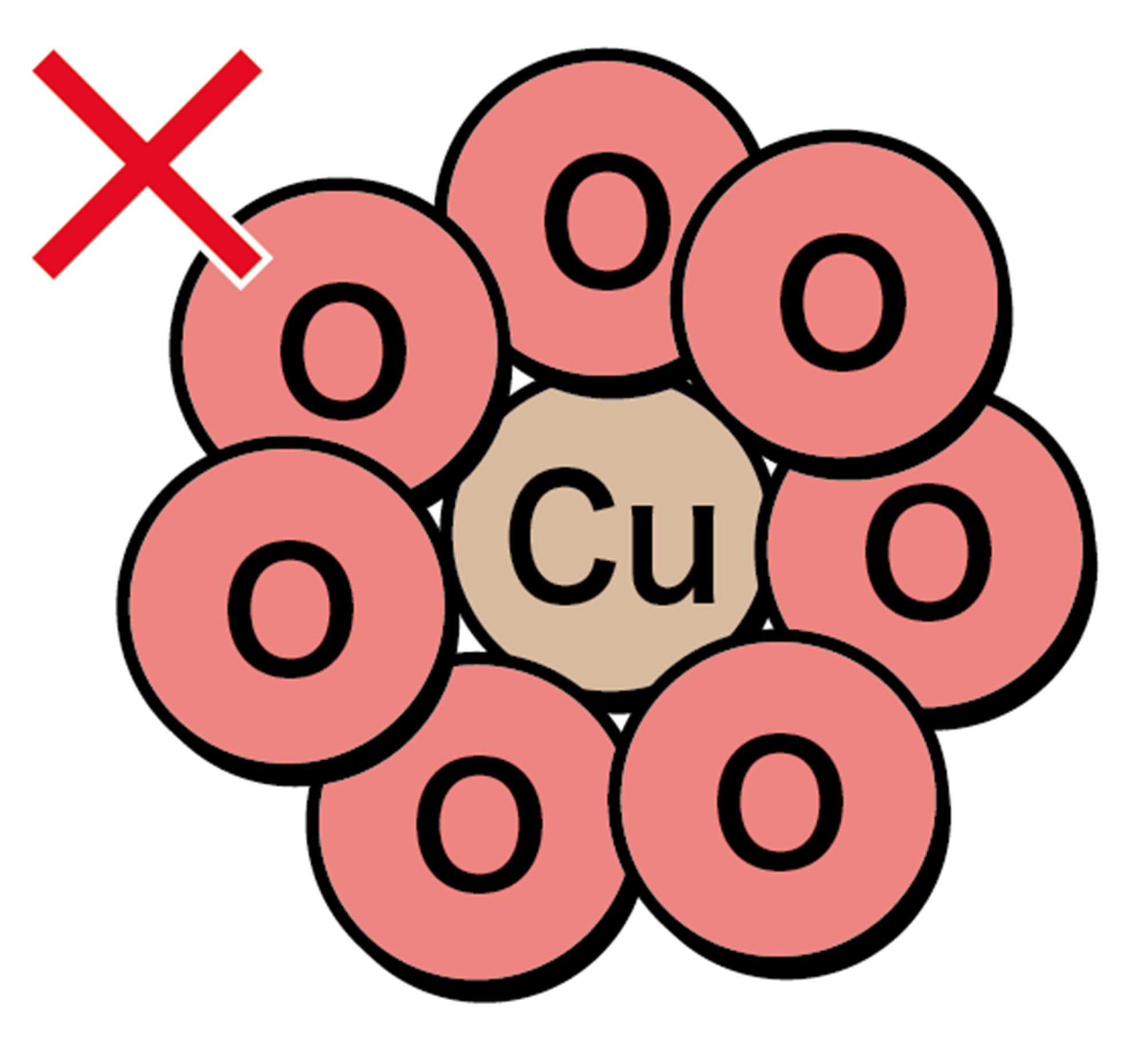
たとえまわりに酸素分子がたくさんあっても,銅原子1つには,酸素原子1つしか結びつかないのかな。このとき,全体の質量は,どのように変化すると予想できるかな。
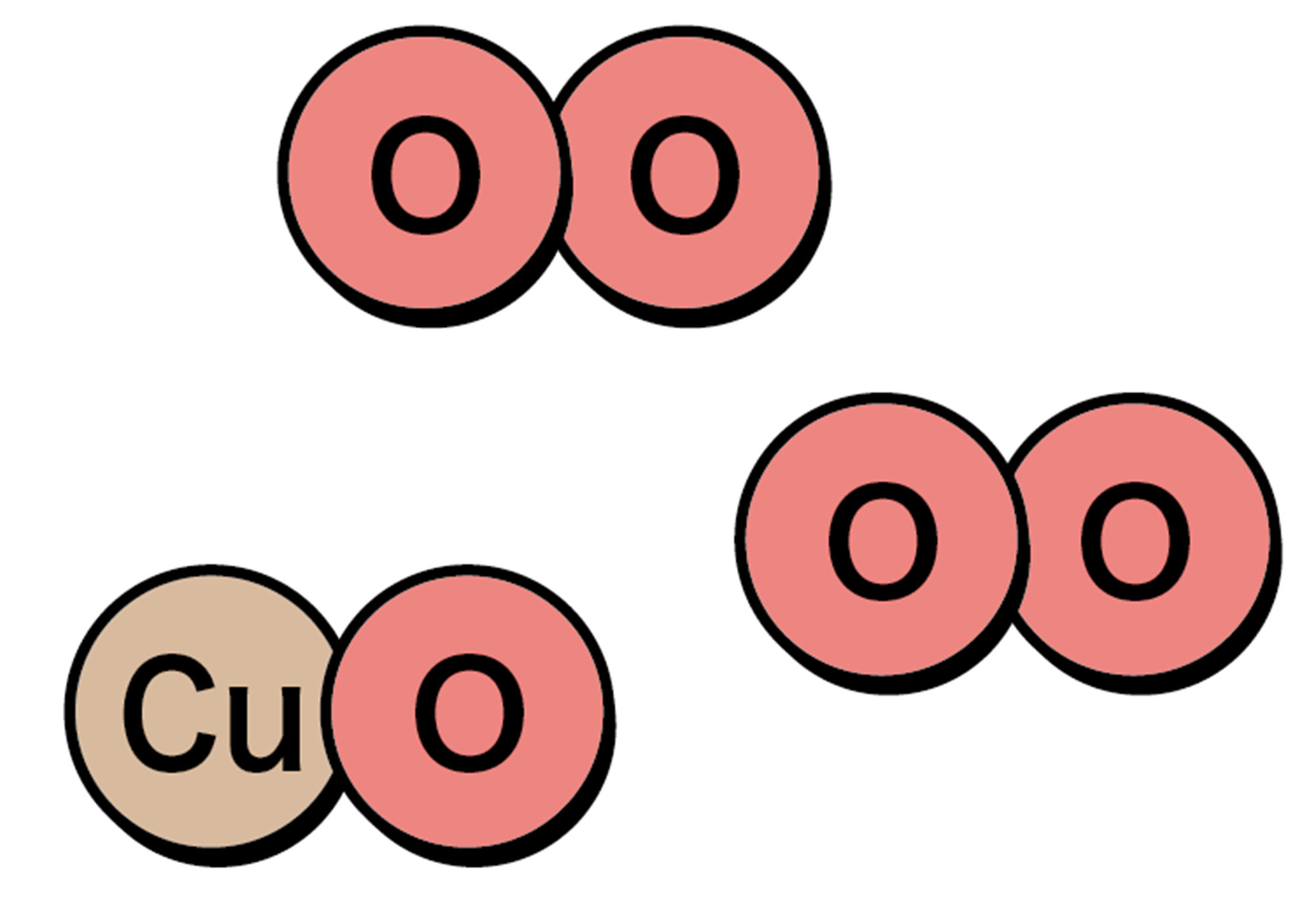

図 8 酸素が結びつく化学変化の考え方
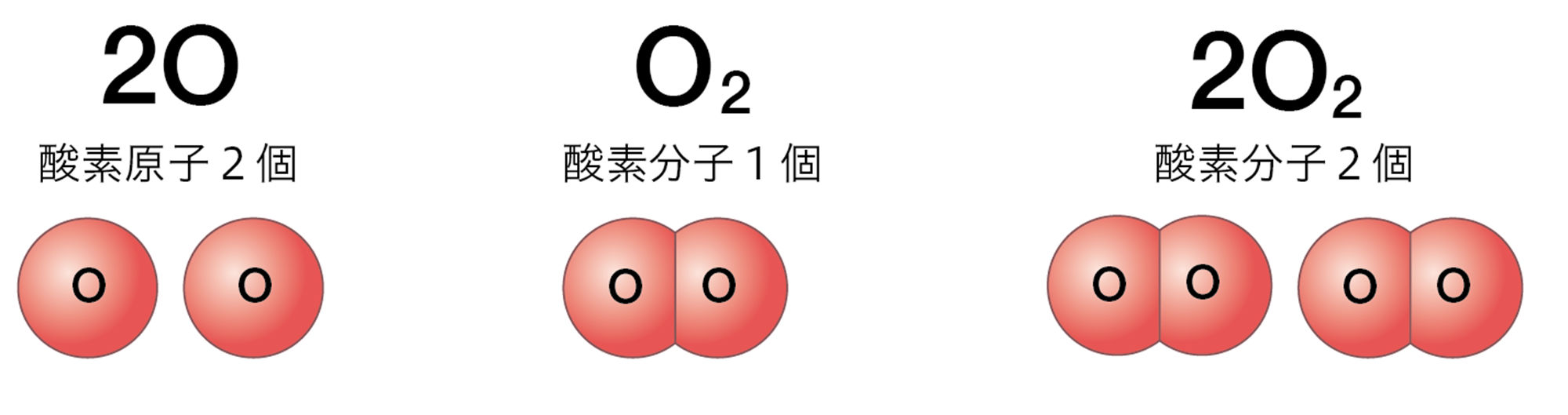
数の意味のちがいをもう一度確認しておきましょう。

準備
銅粉,ステンレスの皿,るつぼばさみ,薬さじ(ステンレス製),ぞうきん,電子てんびん,加熱器具
実験A くり返し加熱し,質量の変化を調べる
※このウェブページは中学校理科2年の学習内容です。<2年p.47>
実験B 質量を変えて加熱する
① 質量をはかる
ステンレスの皿の質量をはかったあとに,班ごとに銅粉を0.2g,0.4g,…と質量を変えてはかり取る。
② 加熱する
銅粉を皿に広げ,強火で加熱する。黒くなるまで薬さじでかき混ぜながらよく加熱する。
③ 加熱後の質量をはかる
色が変化したら加熱をやめ,よく冷やしてから,皿全体の質量をはかる。②と③の操作をくり返し,全体の質量が一定になるまで続ける。
ポイント
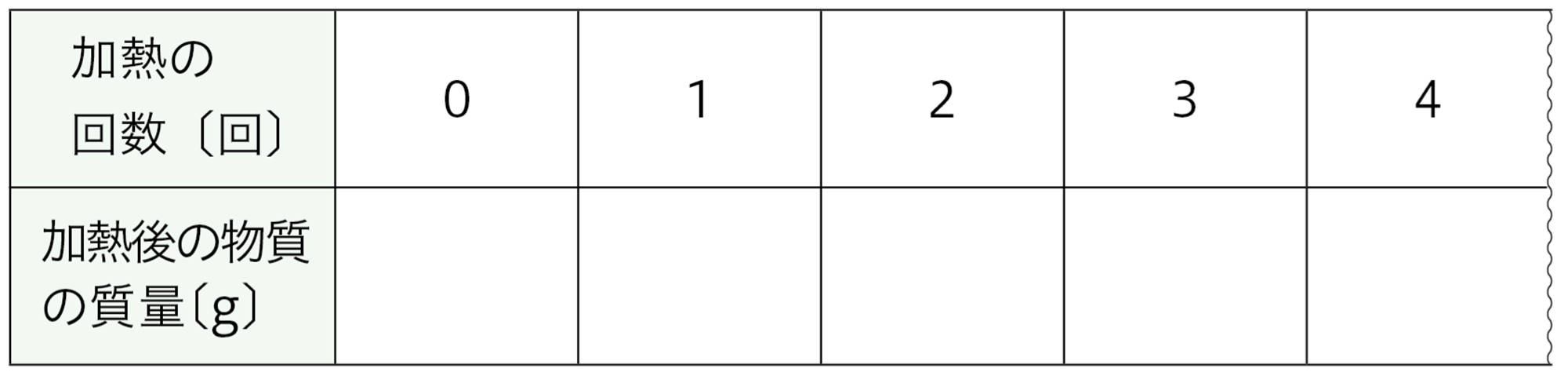
A はかり取った銅粉について,加熱をくり返したときの質量の変化を記録する。
ポイント
B はかり取った銅粉の質量ごとに,加熱をくり返して質量が変化しなくなったときの値を記録する。
ポイント
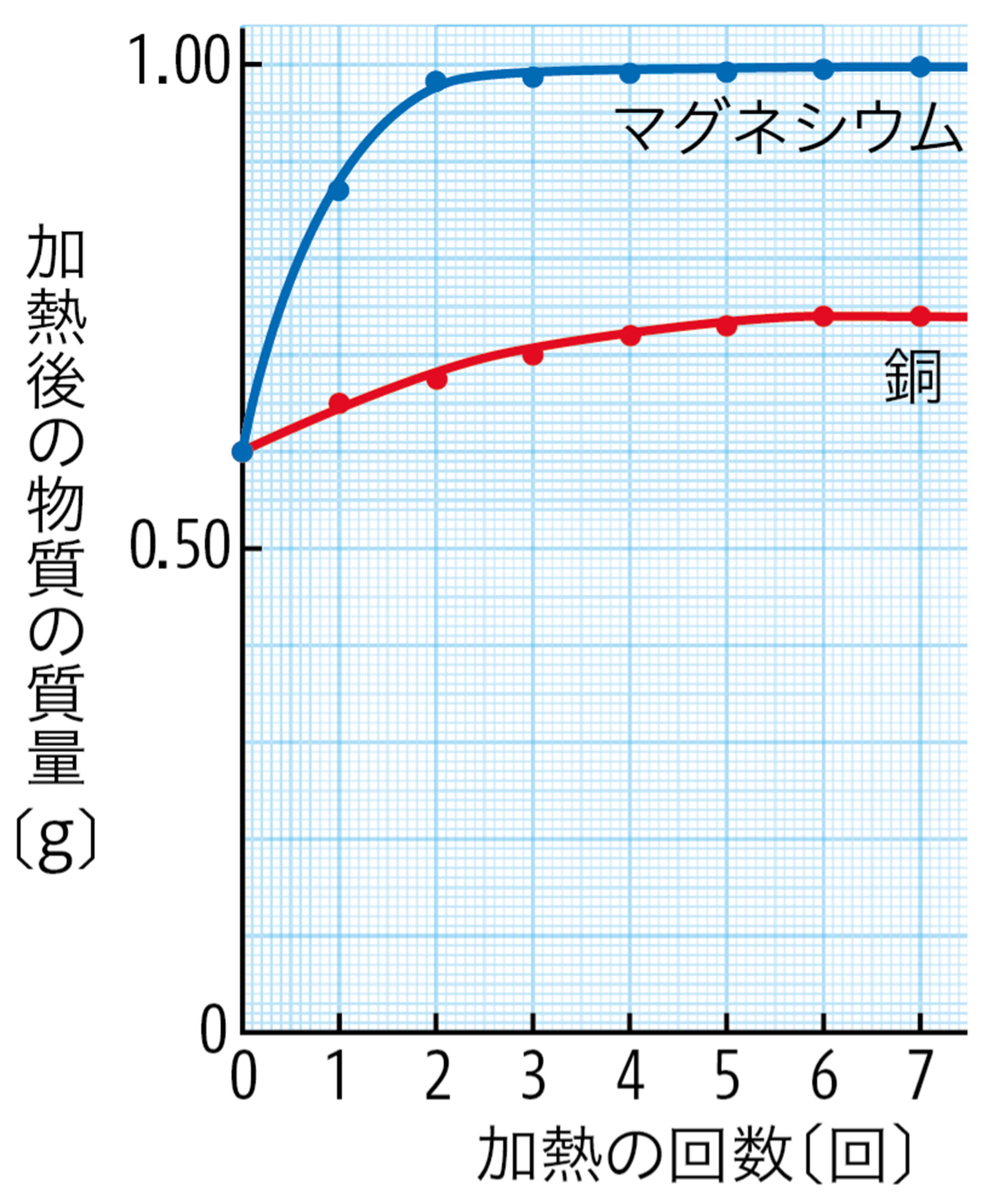
・ A から,加熱する回数と加熱後の物質の質量の変化について何がいえるか。
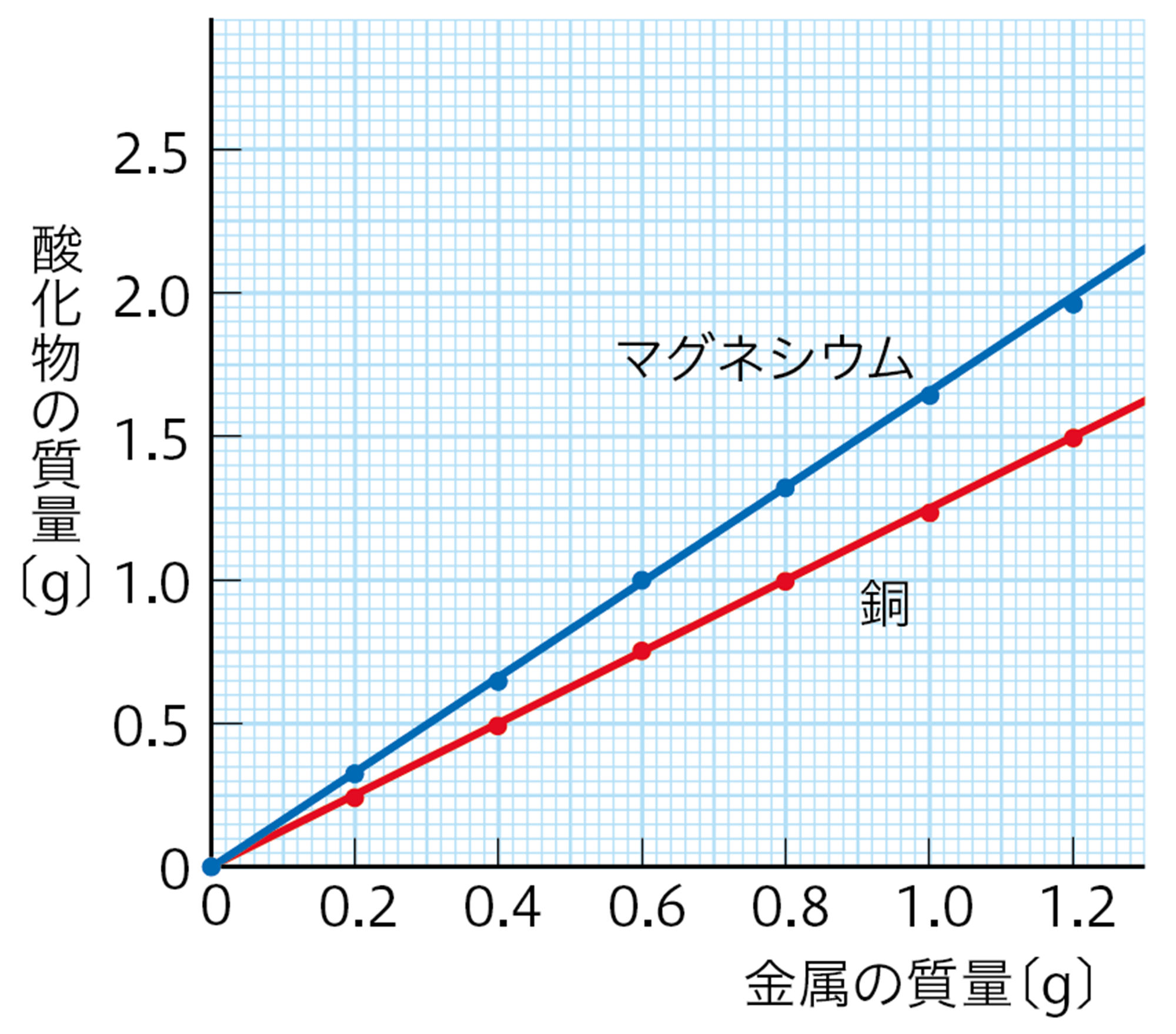
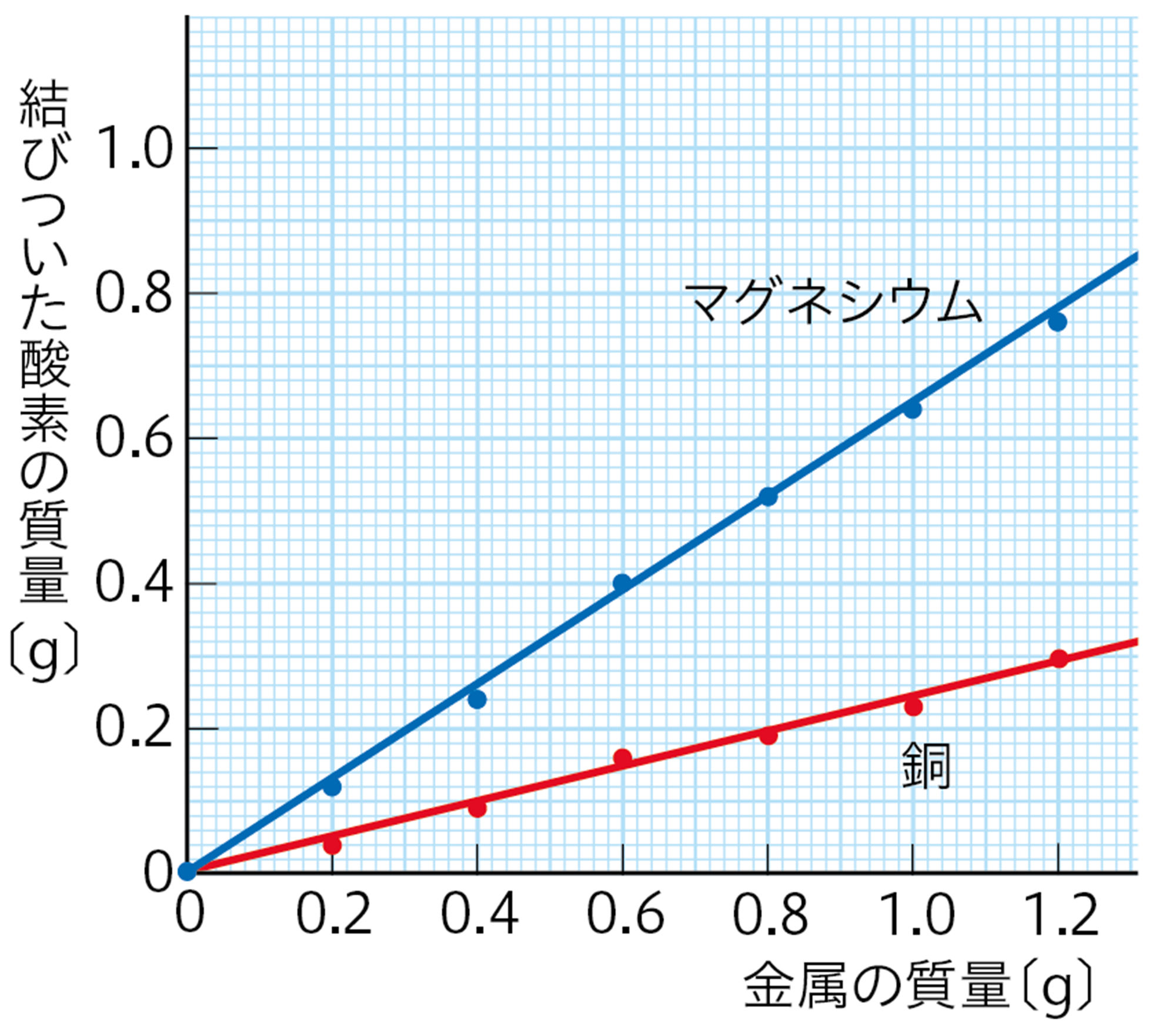
・ B から,銅の質量と結びついた酸素の質量の関係を求める。
● 化学変化の前後での質量の変化は,化学反応式からどのように説明できるか。
別法
※このウェブページは中学校理科2年の学習内容です。<2年p.48>
探究6 結果から考察する
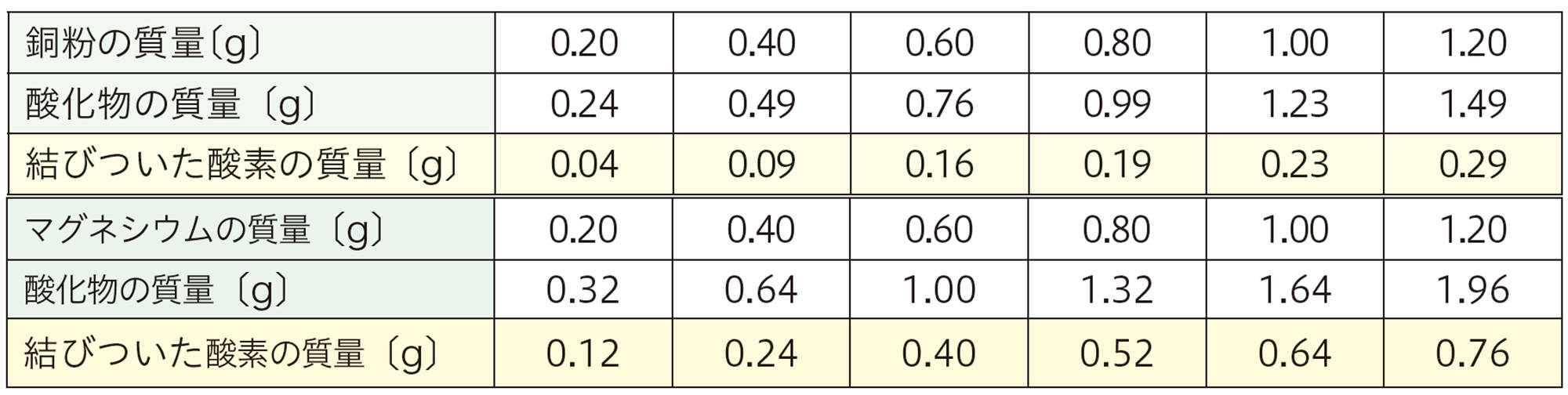
「結びついた酸素の質量」は,酸化物の質量と金属の質量の差から求めました。

質量が変わらなくなるまで加熱をくり返し,小数第二位まではかることのできる電子てんびんを使ったときの結果例である。また,この表にはマグネシウムの結果例も示している。
表 2 探究 6 実験 B の結果例
図10 表2をグラフにした例
- 銅の酸化の化学反応式(2Cu + O2 → 2CuO) から,銅原子1つに結びつく酸素原子は1つであるといえる。図9 のように,銅の粉末を加熱しても質量が際限なく増えるわけではないことは,化学反応式の考えと一致する。
- 図10 から,金属の質量と結びついた酸素の質量は比例していることがわかる。つまり,金属と酸素が結びつくとき,それぞれの質量の比は一定である。

自分たちの結果が,図10とちがいます…
その場合は,なぜ結果がちがったのか考えてみましょう。

※このウェブページは中学校理科2年の学習内容です。<2年p.49>
探究6で,金属とその酸化物の質量の比は一定であり,これは一定の質量の比の酸素と結びついたことを表している。一般に,物質Aと物質Bが結びついて化合物Cができるときは,AとBはいつも一定の質量の比で結びつく❶。
一定の質量の比で結びつくべき物質Aと物質Bの質量のいずれかに過不足があれば,多い方の物質が化学変化しないで残る(p.48「探究を深める理路整然」)。
5 さまざまな化学変化と化学反応式
これまであつかってきた化学変化,それ以外の化学変化も,化学反応式で表現することができる。図11〜15で,具体的な現象と化学反応式を理解しよう。
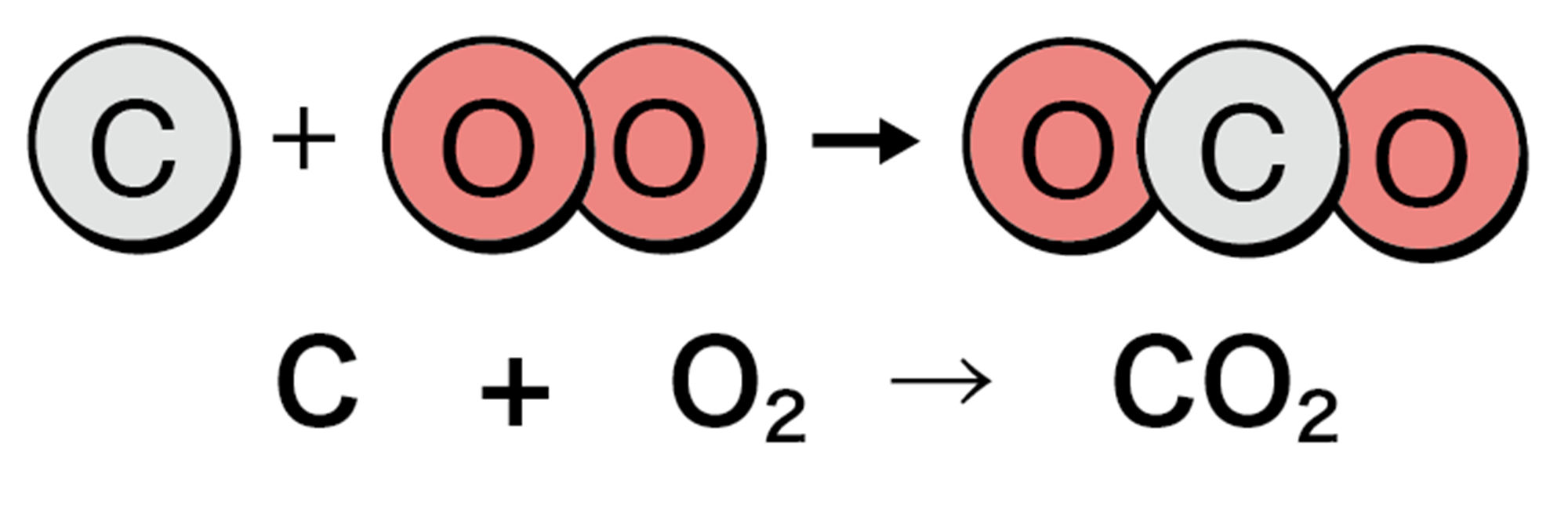
酸素を入れて密閉したフラスコの中で炭(炭素C)を燃焼させたところ,炭はほぼなくなった。
どの化学変化でも,質量保存の法則が成り立っています。

図11 炭素の燃焼
❶ 物質Aと物質Bをつくっている原子どうしが,決まった割合で結びつくためである。
※このウェブページは中学校理科2年の学習内容です。<2年p.50>
水素と酸素を2 : 1の体積の割合で混合した気体を密閉した袋に入れる。そして点火装置で点火すると,一瞬,爆発音がして,袋の中が水滴でくもる。

水素に酸素が激しく結びつくから,これも燃焼といえるね。水の電気分解と逆の反応だね。
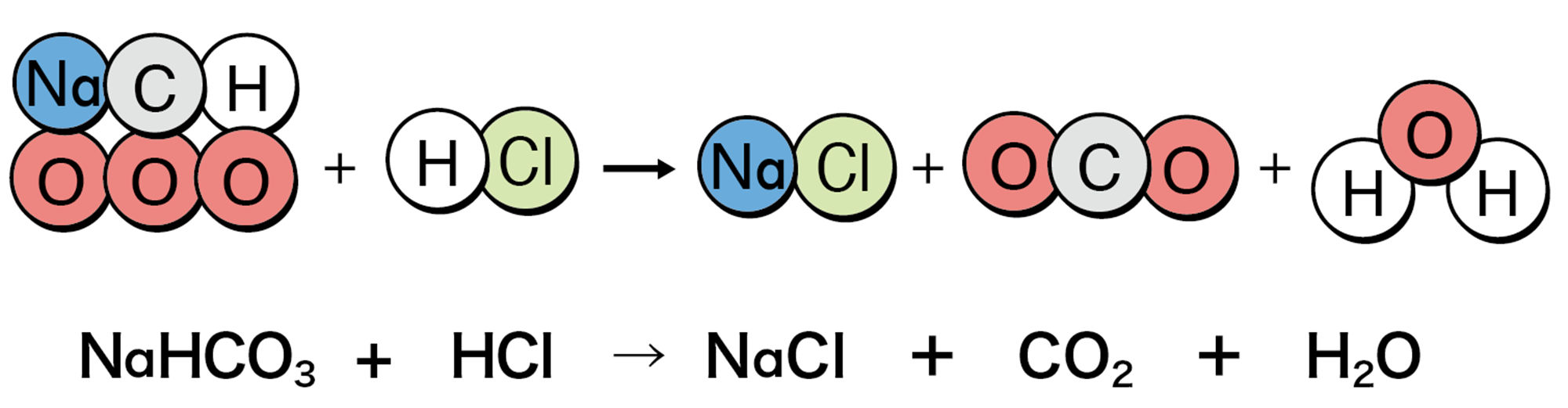
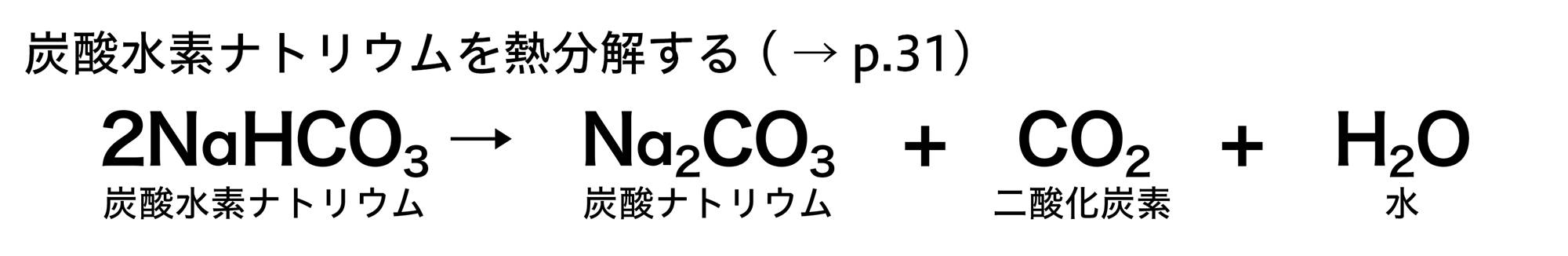
炭酸水素ナトリウムに塩酸を加えると気体が発生する。気体は石灰水を白くにごらせることから二酸化炭素であることがわかる。また,炭酸水素ナトリウムが完全に見えなくなってから,水を蒸発させると塩化ナトリウムの結晶が現れる。

炭酸水素ナトリウムは,この反応以外に,探究4で調べた加熱による分解もできましたね。
※このウェブページは中学校理科2年の学習内容です。<2年p.51>
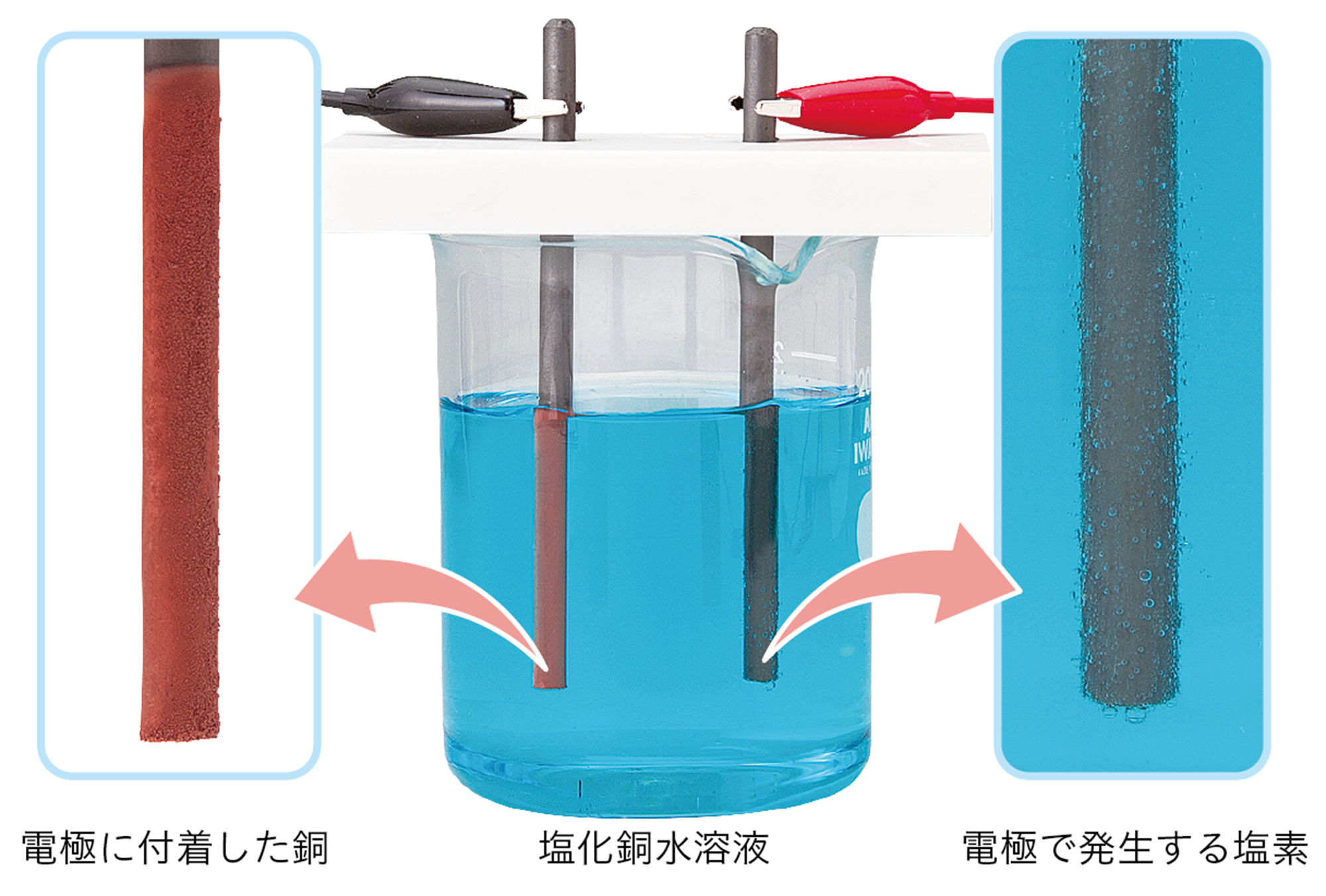
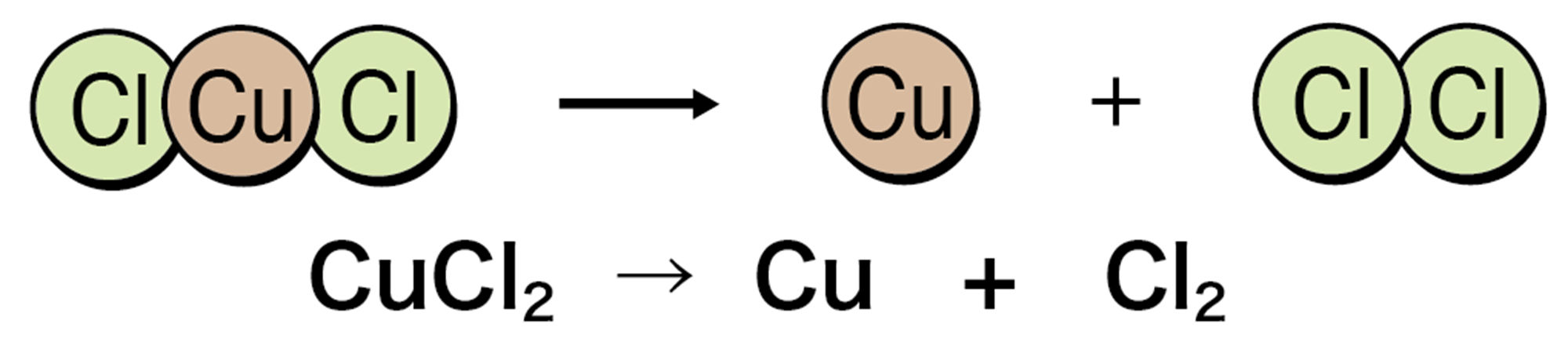
塩化銅CuCl₂の水溶液に電流を流すと,一方の電極には赤色の銅が付着する。もう一方からは,特有の刺激臭がある気体の塩素Cl₂が発生する。

この電気分解については,3年生でくわしく学びます。
発展
スチールウールの燃焼では,主に2種類の化学変化が起こる。
3Fe + 2O₂ → Fe₃O₄
2Fe + O₂ → 2FeO
砂糖(ショ糖)が,完全に酸素と結びついて燃焼したときの化学反応式は,下のように表すことができる。
C₁₂H₂₂O₁₁ + 12O₂ → 12CO₂ + 11H₂O
図15 その他の化学変化のおさらい
ニュース
- 【今,タンポポは雑種だらけ!?タンポポ見分け散歩に参加した】 2023年3月1日多くの人にとって身近な春の花,タンポポ。 花の下にある「総苞片」が反り返っているものは外来のセイヨウタンポポ,ということは比較的知られていますが,現在の日本の都市部で見られるタンポポは,実はタンポポセイヨウタンポポと在来のタンポポの3倍体雑種や4倍体雑種が大半です。文一総合出版のハンドブックシリーズ「タンポポハンドブック」の著者・保谷彰彦さんと,実際にタンポポを観察し,見分けながら歩いたレポートです。 もと記事リンク
- 【九州大学がリアルすぎる「3Dデジタル生物標本」1400点以上を公開!】 2023年3月1日360°自由にぐるぐる動かせて,細かいところまでズームで拡大することができる高精細な3Dデジタル生物標本が1400点も一挙に公開されました。 公開されたデータは,生鮮時のカラフルな状態で,魚などの水生生物を中心に,昆虫や植物など幅広い種類の生物が含まれています。公開されたデータのほとんどは,CC BY 4.0ライセンスのもと,誰でも自由にダウンロード・利用できます。 この驚異的なデータベース,なんとたった一人の研究者の手によって作成されています。九州大学の同僚の生物学者たちが口々に「変態」と讃える鹿野雄一特任准教授の凄技,ぜひ一度ご覧あれ。 もと記事リンク 生物標本
- 【新種発見に備えろ! 生き物好きにおすすめ「学名生成ツール」】 2023年3月1日「もしも新種の生物を発見したら,どんな名前をつけよう?」 生物好きならきっと一度は夢想したことがあるでしょう。身近な場所に大発見が潜んでいるかもしれないし,過去には国立科学博物館で新種のハチのネーミングキャンペーンが行われたこともあり,ひょっとしたらあなたも新種の名づけに関わることがあるかもしれないのです。 そんな「もしも」の時にも役立つ「学名生成ツール」が公開されました。選んだ言葉を入力項目に入れ,いくつかの必要事項を選択すると,学名に使われているラテン語での表記が完成します。いろいろな言葉を入れてみて結果を比べてみると,図鑑の学名を見るときの味わいが増すでしょう。もちろん,もし学名を考えることになっても,準備はばっちりです。 もと記事リンク
- 【その生き物,採っても大丈夫? 分かりやすい解説本が出ました!】 2023年3月1日名前が分からない生き物を調べようと持ち帰りSNSにアップしたら,実は天然記念物でSNSが炎上! 釣った魚を飼っていたら実は特定外来生物だった!……など,生物に関わる中で,法律を知らなかったがゆえにトラブルとなるケースが起こっています。生き物を採取したり飼育したりする行為には,「種の保存法」「外来生物法」や,「文化財保護法」「漁業法」,それに各地の条例などが関わっており,法律を知らないと思わぬトラブルに巻き込まれるリスクがあります。 この本は,そのような生き物に関わるさまざまな法律を分かりやすく解説した一冊です。科学部の顧問など,生徒とともに生き物と関わる方には特におすすめです。 『いきもの六法 日本の自然を楽しみ、守るための法律』 中島慶二監修/益子知樹監修/山と溪谷社いきもの部編 山と渓谷社 2022年3月25日発売 ¥1,980(税込) ISBN 9784635590518 もと記事リンク
- 【図鑑を見ても,生物の名前が分からないのはなぜ?】 2023年3月1日生物のことを深く知りたい,と思ったとき,多くの場合,その生き物の名前を調べること(同定)が必要となります。 生物に詳しい人は,見れば「なんとなく」あの仲間だな,ということが分かってしまい,それを言語化することが難しい。一方で分からない人からすると,どこを見ればいいのか,差はあるがこれは個体差なのか種間の差なのか…無数のつまづきがあって,結局「分からない」となってしまいがちです。 どのようにして「同定」という作業がなされているかを丁寧に言葉にしたこの本は,「科学」の見方・考え方を獲得する過程が言語化されているといえるでしょう。 『図鑑を見ても名前がわからないのはなぜか? どうしても名前を知りたい! 進め!同定の道』 須黒達巳 著 ベレ出版 2021年12月 ¥2,200(税込) ISBN:978-4-86064-676-9 もと記事リンク