※このウェブページは中学校理科3年の学習内容です。<3年p.132>
1|酸とアルカリ
1 酸性・アルカリ性
小学校では,水溶液に,酸性・中性・アルカリ性があることを学んだ。これまでに学んだそれぞれの水溶液の性質は,次のようにまとめることができる。
酸性の水溶液の性質
- 青色リトマス紙を赤色に変える。
- マグネシウムを入れると水素が発生する。
- 電解質の水溶液である。
中性の水溶液の性質
- 赤色,青色リトマス紙,どちらの色も変えない。
- マグネシウムを入れても変化がない。
- 電解質の水溶液とはかぎらない。
アルカリ性の水溶液の性質
- 赤色リトマス紙を青色に変える。
- マグネシウムを入れても変化がない。
- 電解質の水溶液である。
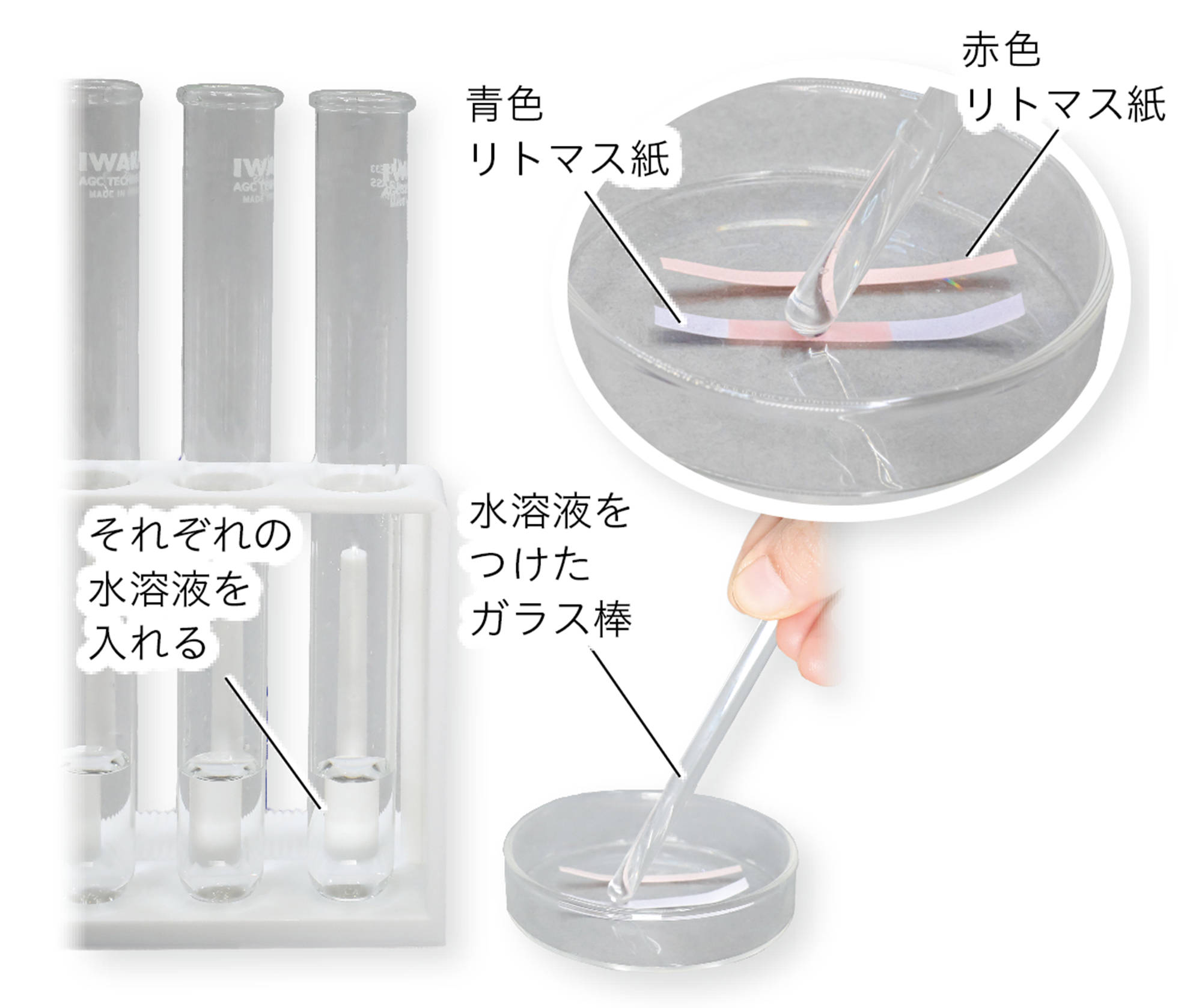
図1 酸性やアルカリ性の水溶液の性質を確かめる実験
※このウェブページは中学校理科3年の学習内容です。<3年p.133>
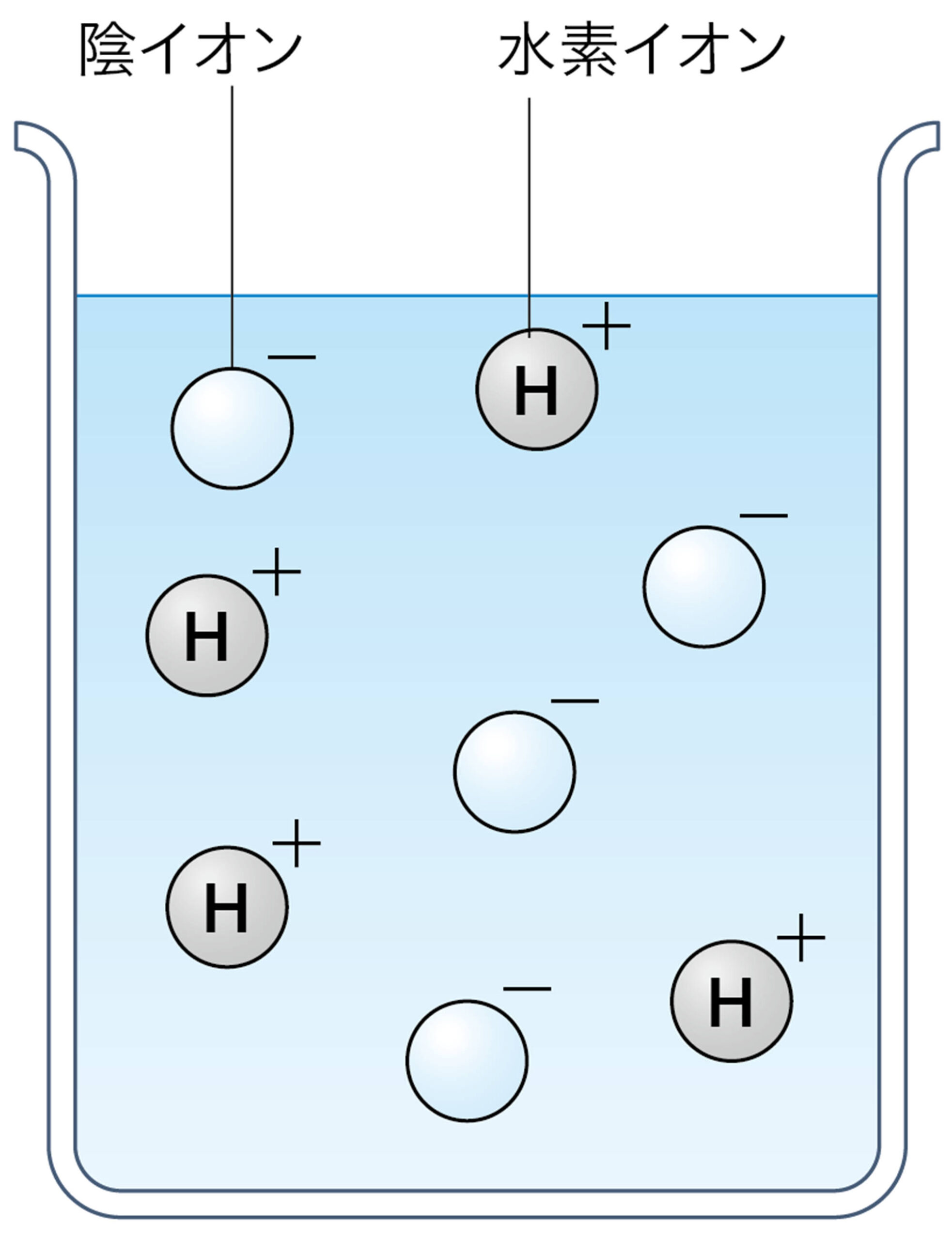
水溶液になったときに酸性を示す化合物を酸という。また,【アルカリ性】を示化合物をアルカリという❶。
異なる物質であっても,それらの水溶液は共通して酸性を示したり,またはアルカリ性を示したりする。このことから,物質によって酸性を示す要素やアルカリ性を示す要素が共通していることが予想できる。これらのしくみについて,どのように科学的に探究できるだろうか。
探究3 酸・アルカリの正体

酸とアルカリに共通の性質があります。電離を表す式から考えてみましょう。
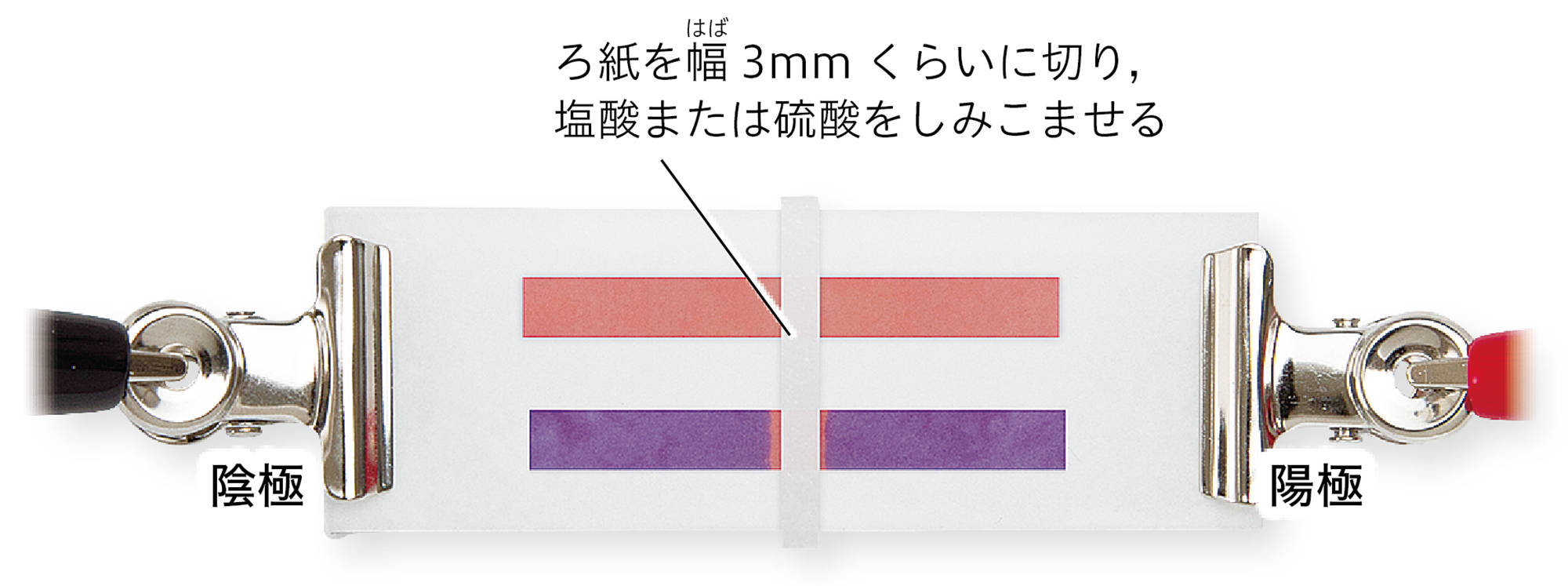
図2 酸性やアルカリ性の水溶液の電気分解
酸とアルカリは性質が反対だと思うけど,何か共通点があるかな?

そうだ!どっちも電解質だ。第1章の探究1で,酸性の水溶液もアルカリ性の水溶液もあったよ。

酸性・アルカリ性は,水溶液中の何によって決まるか。

酸性やアルカリ性の水溶液を電気泳動したら,どうなるのかな。
それぞれの水溶液に共通するイオンがあるんじゃないかな?どちらも電解質の水溶液だから。


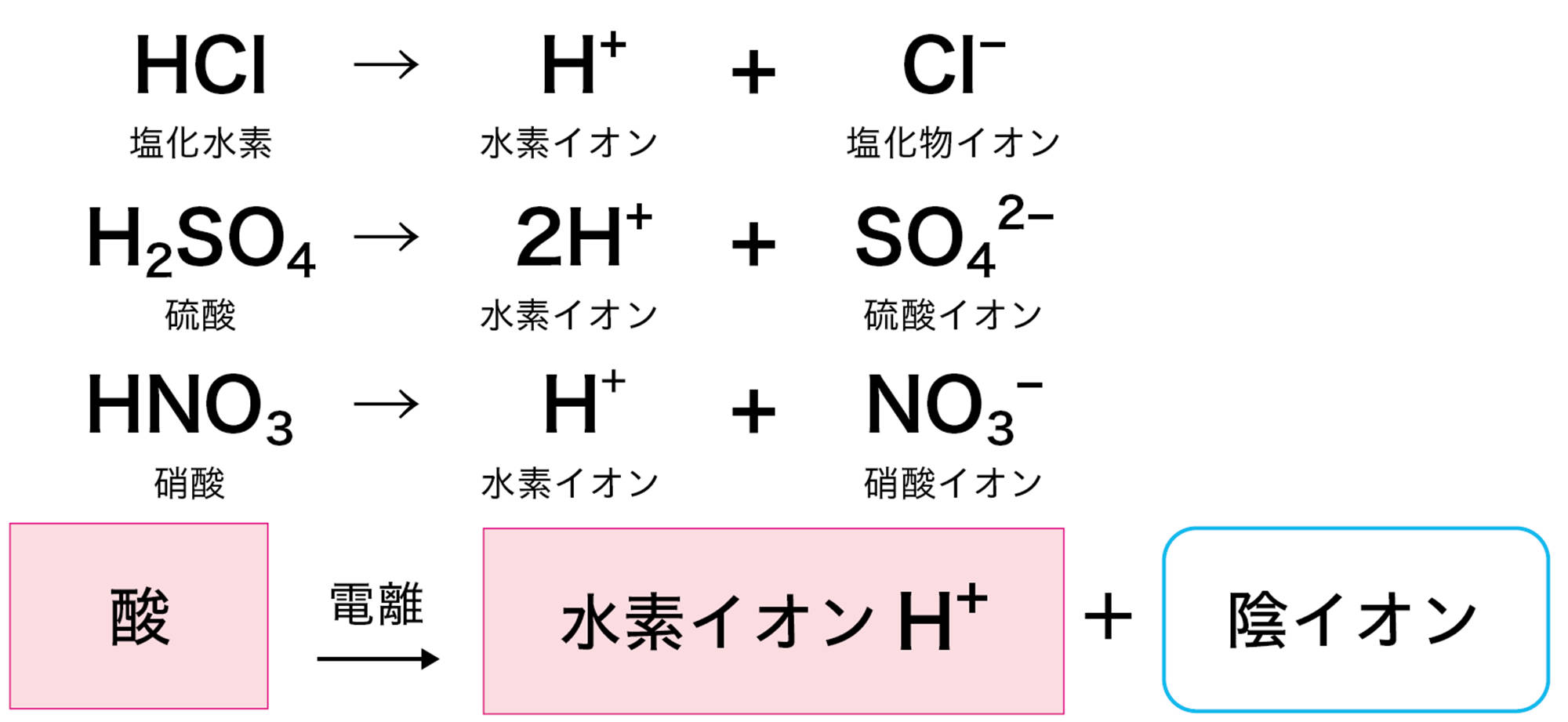
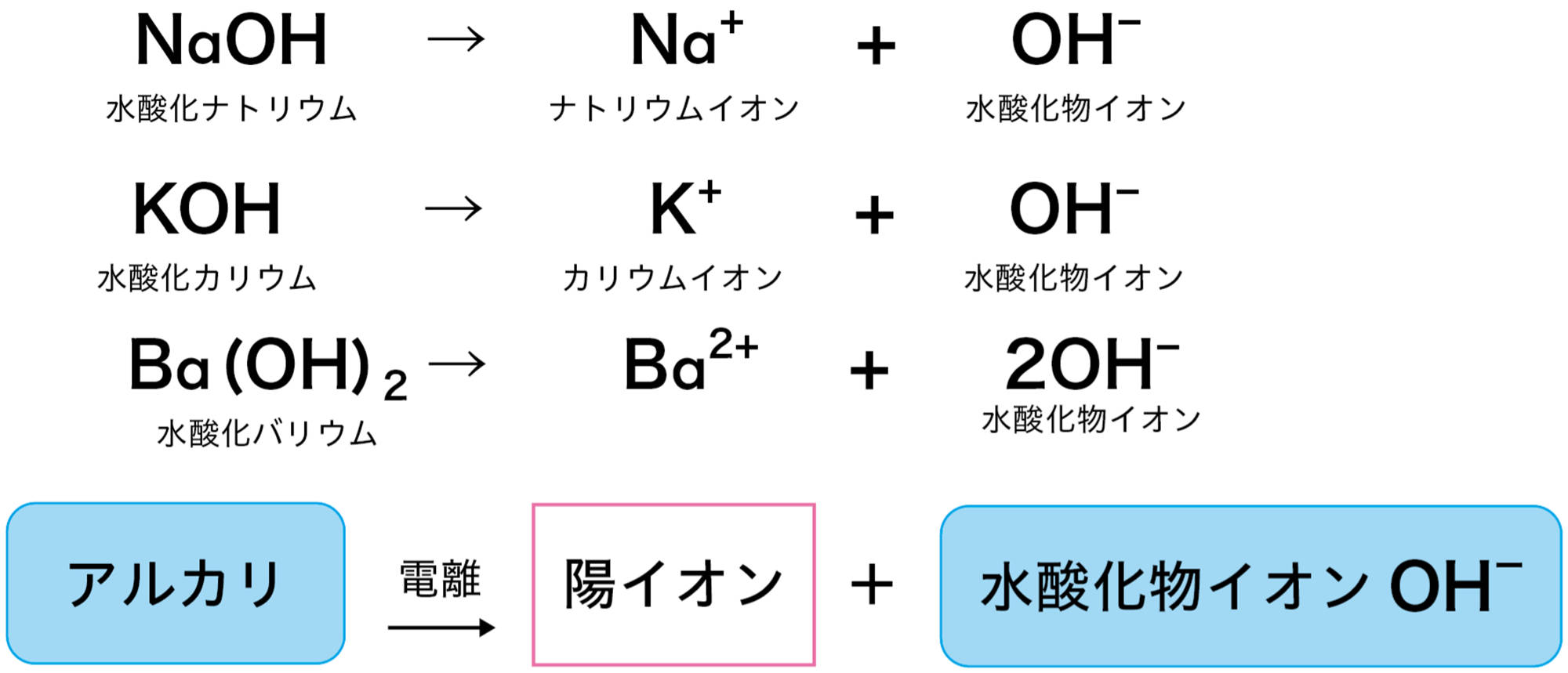
電離を表す式にヒントがあるかな。塩酸は
HCl → H⁺ + Cl⁻
水酸化ナトリウム水溶液は
NaOH → Na⁺ + OH⁻

酸やアルカリの正体は,どうやったら確かめられるのかな。
電解質の陽イオンと陰イオンは,電極に引きつけられたよね。


酸性・アルカリ性を確かめる試薬を準備しよう。
❶ 酸(英語でacid)は「酸っぱい」を表すラテン語のacidusに由来しており,アルカリ(英語でalkali)は「灰」を意味するアラビア語のal qilyに由来するとされる。植物を燃やしたあとの灰に水を加えると,灰にふくまれるイオンによって,水がアルカリ性を示す。
※このウェブページは中学校理科3年の学習内容です。<3年p.134>

酸性の液体で,青色リトマス紙が赤色に変わるよね。色の変化と,この水溶液中の陽イオンや陰イオンの広がりは,どのように結びつけられるだろう。
準備
塩酸(1%),硫酸(1%),水酸化ナトリウム水溶液(1%),水酸化カリウム水溶液(1%),食塩水(5%),リトマス紙,ろ紙,スライドガラス,目玉クリップ(2),電源装置,ピンセット,クリップつき導線,バット,色えんぴつ,はさみ,保護めがね
注意!! 保護めがねをかける。
1.実験装置を組み立てる
2.酸性の水溶液に電圧をかける
※このウェブページは中学校理科3年の学習内容です。<3年p.135>
ポイント
リトマス紙の色の変化を色えんぴつでぬり,記録する。
ポイント
酸性を示す物質,アルカリ性を示す物質は,それぞれ,+と − のどちらの電気を帯びているか。それぞれの水溶液の性質を決める正体は何だといえるか。
エタノール水溶液,砂糖水,硝酸カリウム水溶液など,中性の水溶液でも調べてみましょう。

※このウェブページは中学校理科3年の学習内容です。<3年p.136>
探究3 結果から考察する
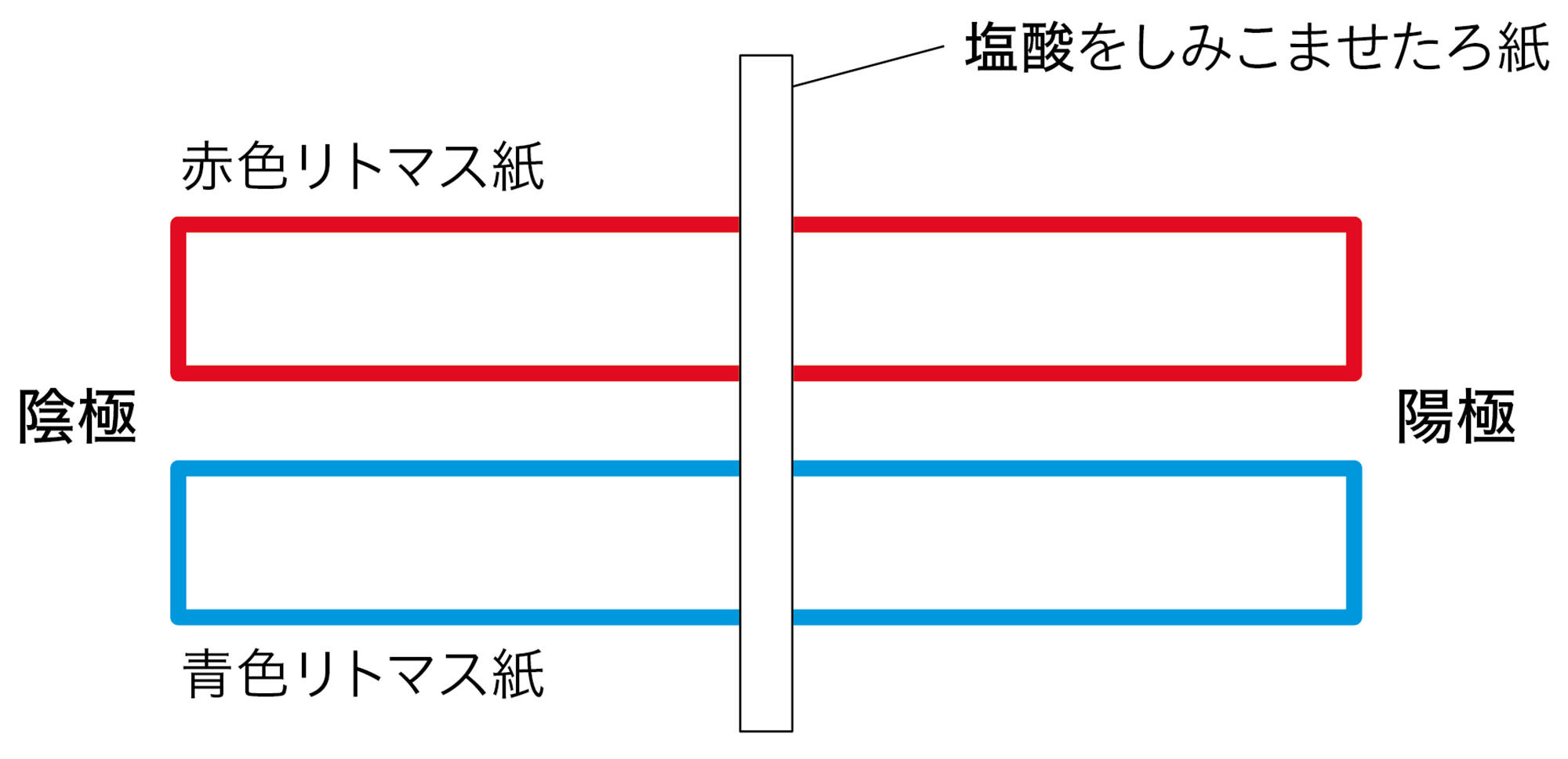
図3 探究3の酸の結果例
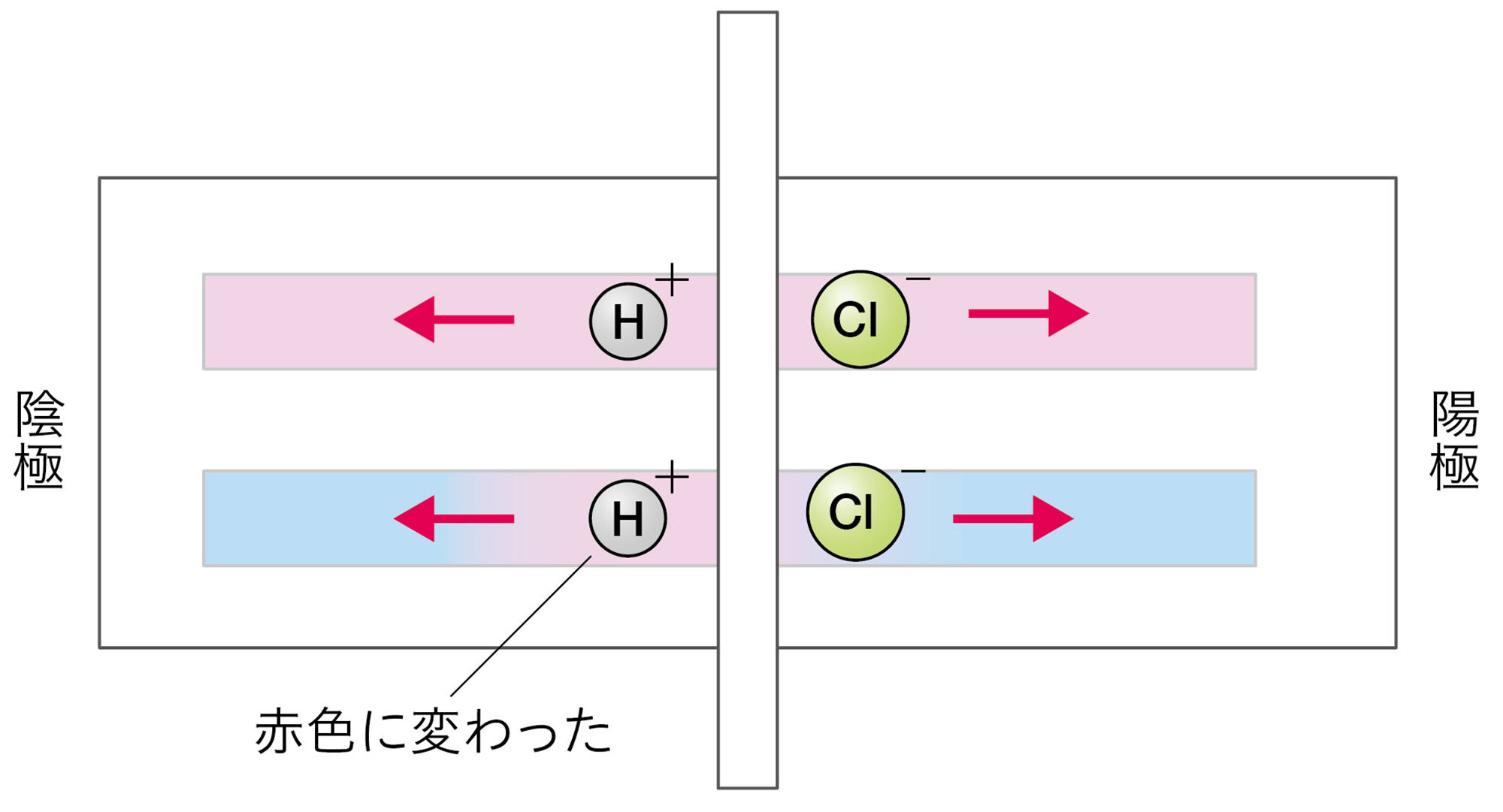
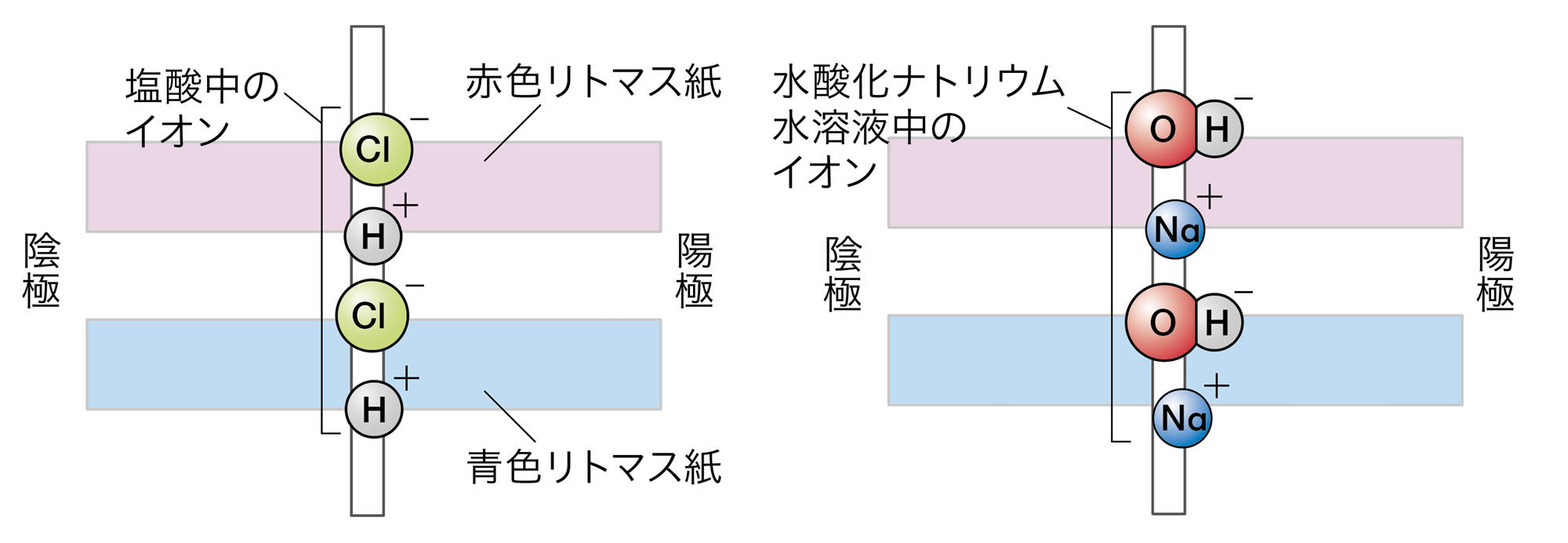
塩酸や硫酸の場合は,青色リトマス紙の陰極側が赤色に変わった。
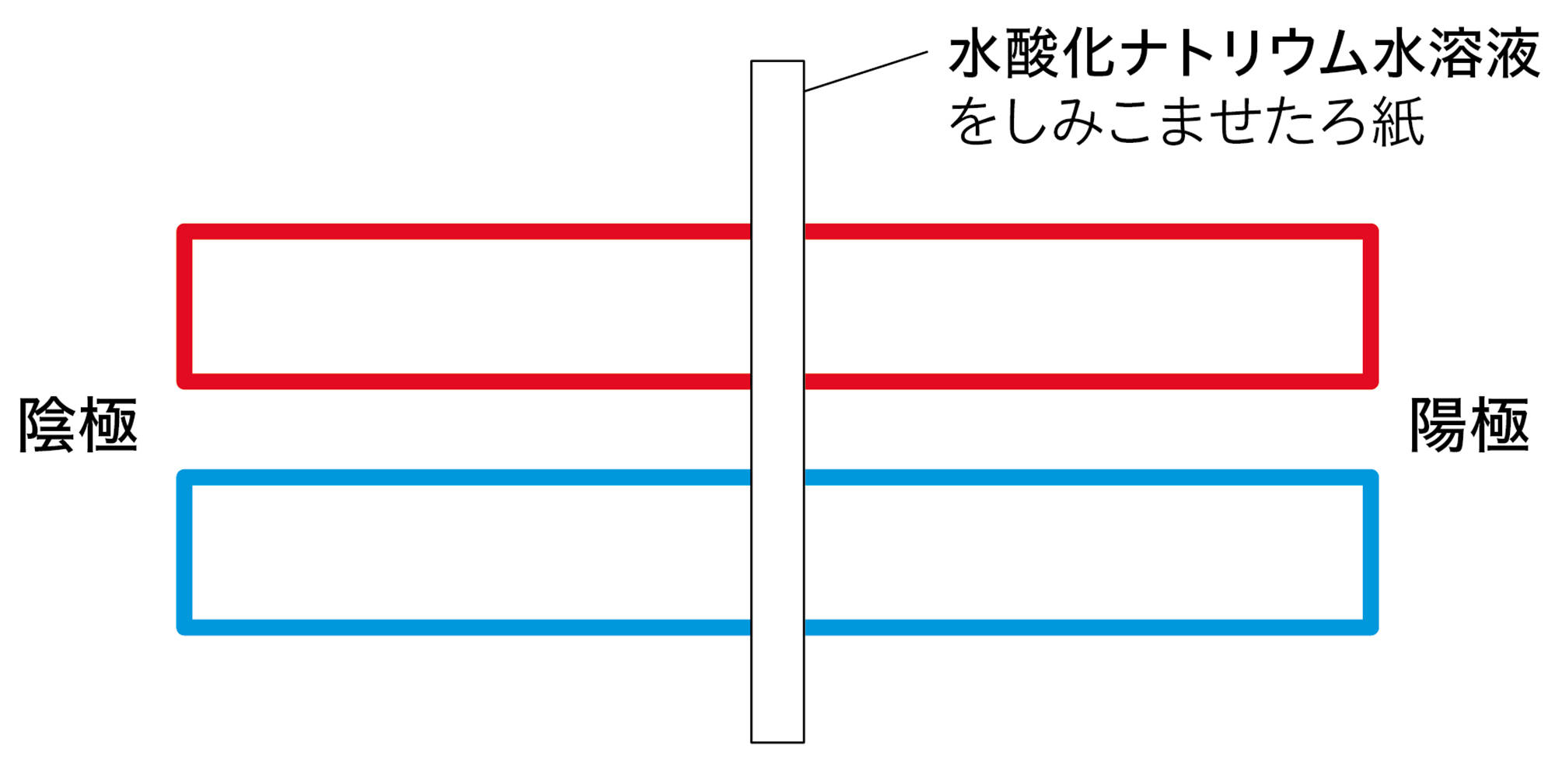
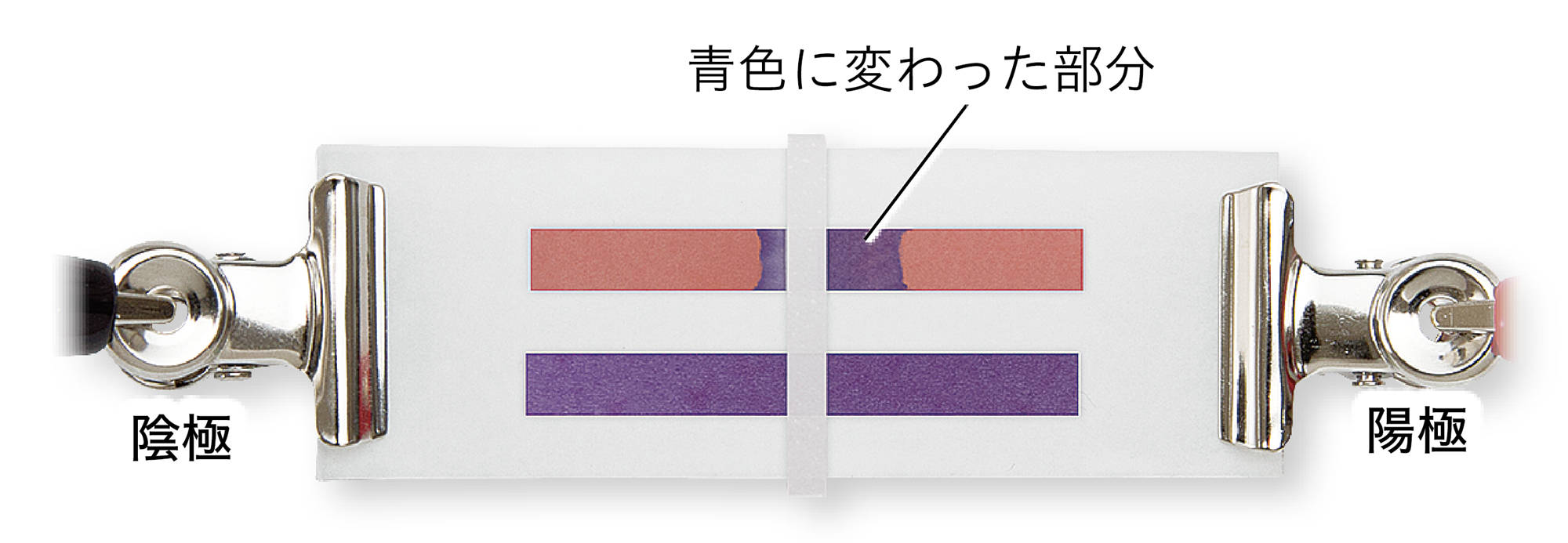
図4 探究3のアルカリの結果例
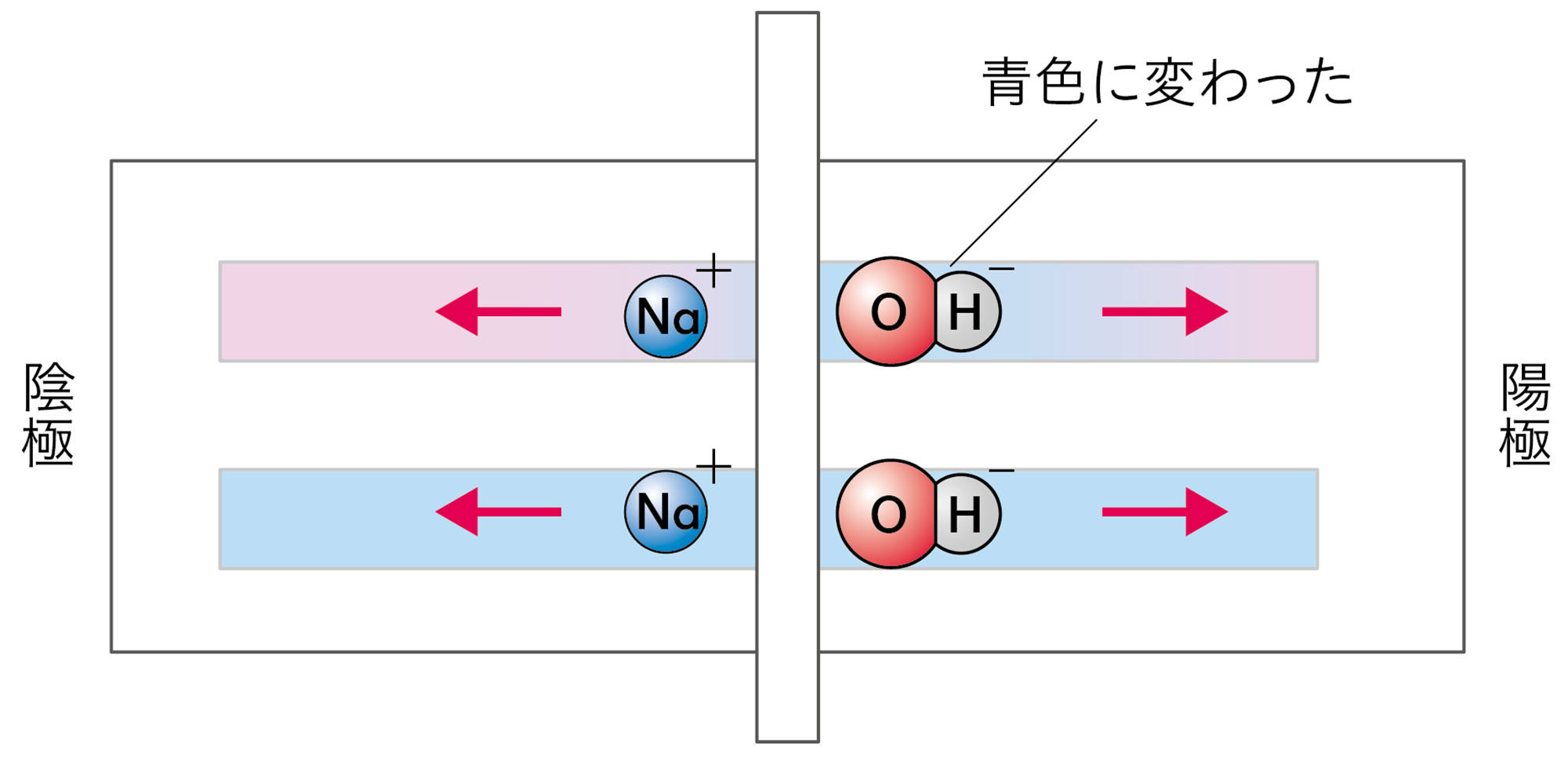
水酸化ナトリウム水溶液,水酸化カリウム水溶液の場合,赤色リトマス紙の陽極側が青色に変わった。
塩酸や硫酸に共通する陽イオンは,水素イオンである。リトマス紙の陰極側が赤色に変わったことから,水素イオンが陰極に引きつけられ,水素イオンがリトマス紙を赤色に変えたと考えることができる。
水酸化ナトリウム水溶液や水酸化カリウム水溶液に共通する陰イオンは,水酸化物イオンである。リトマス紙の陽極側が青色に変わったことから,水酸化物イオンが陽極に引きつけられ,水酸化物イオンがリトマス紙を青色に変えたと考えることができる。
○以上のことから,水素イオンが酸性の性質を示す正体で,水酸化物イオンがアルカリ性の性質を示す正体だと考えられる。
図5 探究3の結果を説明するモデル例
エタノール水溶液,砂糖水,硝酸カリウム水溶液の場合,同じ方法で実験しても変化はありませんでした。

※このウェブページは中学校理科3年の学習内容です。<3年p.137>
2 酸と水素イオン
塩酸や硫酸が酸性を示すのは,水溶液中の水素イオンH⁺のはたらきである。つまり酸とは,水に溶けたとき電離して水素イオンH⁺を生じる化合物である(図6)。
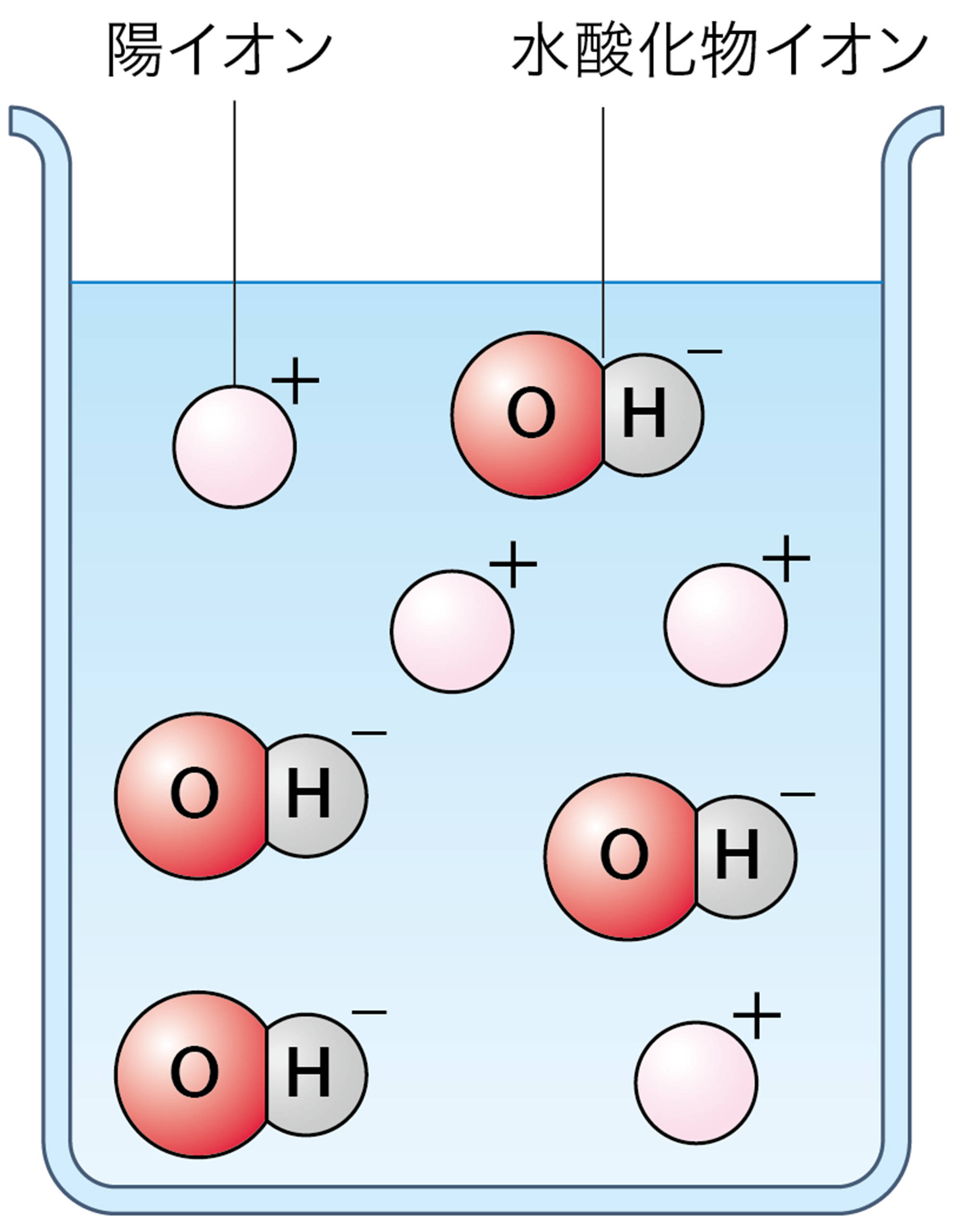
3 アルカリと水酸化物イオン
水酸化ナトリウム水溶液や水酸化カリウム水溶液がアルカリ性を示すのは,水溶液中の水酸化物イオンOH⁻のはたらきである。つまりアルカリとは,水に溶けたとき電離して水酸化物イオンOH⁻を生じる化合物である(図7)。
※このウェブページは中学校理科3年の学習内容です。<3年p.138>
4 酸性・アルカリ性の強さの表し方
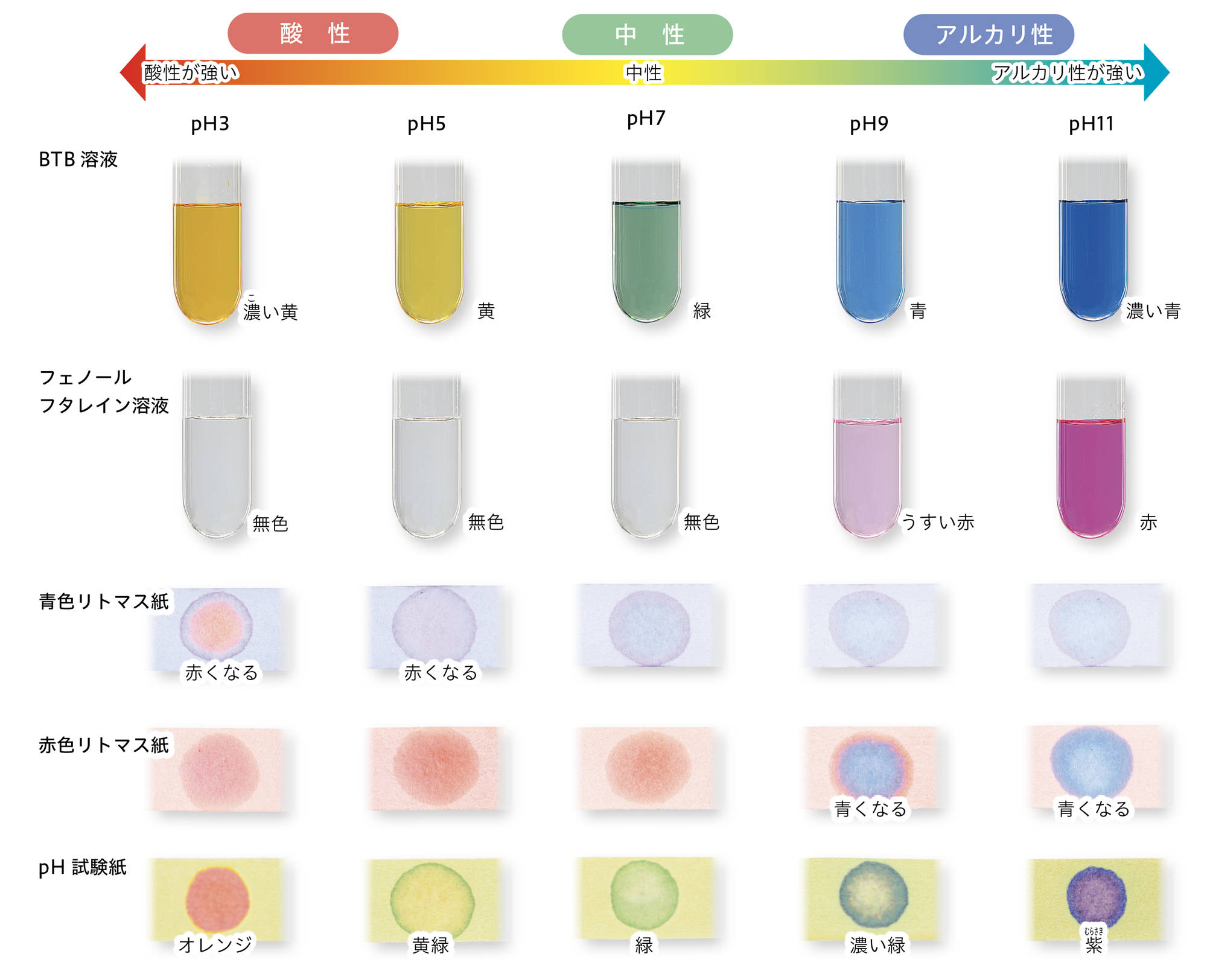
酸性やアルカリ性の強さは,【pH】(ピー・エイチ)という数値で表される。水溶液が中性のときは,pHは7になる。酸性のときは,pHは7より小さくなり,数値が小さくなるにしたがって酸性が強くなる。アルカリ性のときは,pHは7より大きくなり,数値が大きくなるにしたがってアルカリ性が強くなる。
図8 pHをはかる道具
ニュース
- 【白い粉の正体を当てろ! 塩化物5種同定勝負】 2023年3月1日頼れるのは視覚・触覚・嗅覚・味覚と,pH試験紙のみ! 正体不明の白い粉5種類は何か? 見た目,サラサラ具合,pHなどから,塩化物を同定していくクイズ動画です。「塩化アンモニウムの味」など,マニアックな化学物質の知識が問われます。 番組降板を賭けたこの勝負,くられ先生(「アリエナクナイ科学ノ教科書」などの作者)がツナっちに勝つことができるのかも注目です。 もと記事リンク